Термодинамические параметры состояния
Свойства каждой системы характеризуются рядом величин, которые принято называть термодинамическими параметрами. Рассмотрим некоторые из них, используя при этом известные из курса физики молекулярно-кинетические представления об идеальном газе как о совокупности молекул, которые имеют исчезающе малые размеры, находятся в беспорядочном тепловом движении и взаимодействуют друг с другом лишь при соударениях.
Давление обусловлено взаимодействием молекул рабочего тела с поверхностью и численно равно силе, действующей на единицу площади поверхности тела по нормали к последней. В соответствии с молекулярно-кинетической теорией давление газа определяется соотношением
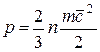 , (1.1)
, (1.1)
где n — число молекул в единице объема;
т — масса молекулы; с2— средняя квадратическая скорость поступательного движения молекул.
В Международной системе единиц (СИ) давление выражается в паскалях (1 Па=1 Н/м2). Поскольку эта единица мала, удобнее использовать 1 кПа = 1000 Па и 1 МПа=106 Па.
Давление измеряется при помощи манометров, барометров и вакуумметров.


 Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением pатм, т.е.
Жидкостные и пружинные манометры измеряют избыточное давление, представляющее собой разность между полным или абсолютным давлением р измеряемой среды и атмосферным давлением pатм, т.е. 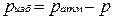
Приборы для измерения давлений ниже атмосферного называются вакуумметрами; их показания дают значение разрежения (или вакуума):
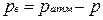 , т. е. избыток атмосферного давления над абсолютным.
, т. е. избыток атмосферного давления над абсолютным.
Следует отметить, что параметром состояния является абсолютное давление. Именно оно входит в термодинамические уравнения.
Температурой называется физическая величина, характеризующая степень нагретости тела. Понятие о температуре вытекает из следующего утверждения: если две системы находятся в тепловом контакте, то в случае неравенства их температур они будут обмениваться теплотой друг с другом, если же их температуры равны, то теплообмена не будет.
С точки зрения молекулярно-кинетических представлений температура есть мера интенсивности теплового движения молекул. Ее численное значение связано с величиной средней кинетической энергии молекул вещества:
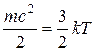 , (1.2)
, (1.2)
где k — постоянная Больцмана, равная 1,380662•10ˉ23 Дж/К. Температура T, определенная таким образом, называется абсолютной.
В системе СИ единицей температуры является кельвин (К); на практике широко применяется градус Цельсия (°С). Соотношение между абсолютной Т и стоградусной I температурами имеет вид
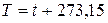 .
.
В промышленных и лабораторных условиях температуру измеряют с помощью жидкостных термометров, пирометров, термопар и других приборов.
Удельный объем v — это объем единицы массы вещества. Если однородное тело массой М занимает объем v, то по определению
v= V/М.
В системе СИ единица удельного объема 1 м3/кг. Между удельным объемом вещества и его плотность существует очевидное соотношение:
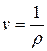
Для сравнения величин, характеризующих системы в одинаковых состояниях, вводится понятие «нормальные физические условия»:
p=760 мм рт.ст.= 101,325 кПа; T=273,15 K.
В разных отраслях техники и разных странах вводят свои, несколько отличные от приведенных «нормальные условия», например, «технические» ( p= 735,6 мм рт.ст.= 98 кПа , t=15˚C) или нормальные условия для оценки производительности компрессоров (p=101,325 кПа, t=20˚С ) и т. д.
Если все термодинамические параметры постоянны во времени и одинаковы во всех точках системы, то такое состояние системы называется равновесным.
Если между различными точками в системе существуют разности температур, давлений и других параметров, то она является неравновесной. В такой системе под действием градиентов параметров возникают потоки теплоты, вещества и другие, стремящиеся вернуть ее в состояние равновесия. Опыт показывает, что изолированная система с течением времени всегда приходит в состояние равновесия и никогда самопроизвольно выйти из него не может. В классической термодинамике рассматриваются только равновесные системы.
Дата добавления: 2016-11-04; просмотров: 1717;











