Изменение энтропии в неравновесных процессах
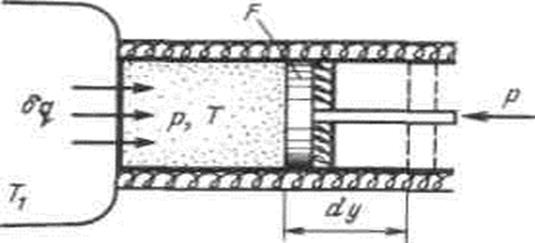
Рассмотрим принципиальные отличия неравновесных процессов от равновесных на примере расширения газа в цилиндре под поршнем, получающего теплоту 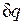 от источника с температурой T1 и совершающего работу против внешней силы Р, действующей на поршень.
от источника с температурой T1 и совершающего работу против внешней силы Р, действующей на поршень.
Расширение будет равновесным только в случае, если температура газа Т равна температуре источника (Т=Т1), внешняя сила Р равна давлению газа на поршень (P=pF) и при расширении газа нет ни внешнего, ни внутреннего трения. Работа расширения газа в этом случае равна 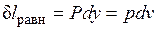 , а изменение энтропии рабочего тела в таком процессе
, а изменение энтропии рабочего тела в таком процессе 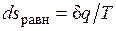 .
.
Невыполнение хотя бы одного из указанных условий делает расширение газа неравновесным. Если неравновесность вызвана трением поршня о стенки цилиндра, то работа 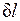 , совершаемая против внешней силы Р, оказывается меньше, чем pdv, так как часть ее затрачивается на преодоление трения и переходит в теплоту
, совершаемая против внешней силы Р, оказывается меньше, чем pdv, так как часть ее затрачивается на преодоление трения и переходит в теплоту 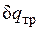 . Она воспринимается газом вместе с подведенной теплотой q, в результате чего возрастание энтропии газа в неравновесном процессе
. Она воспринимается газом вместе с подведенной теплотой q, в результате чего возрастание энтропии газа в неравновесном процессе 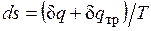 оказывается больше, чем в равновесном при том же количестве подведенной от источника теплоты
оказывается больше, чем в равновесном при том же количестве подведенной от источника теплоты 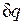 .
.
|
Рисунок 4.6 - К определению изменения энтропии в неравновесных процессах
Если неравновесность вызвана отсутствием механического равновесия (P<pF), поршень будет двигаться ускоренно. Быстрое движение поршня вызывает появление вихрей в газе, затухающих под действием внутреннего трения, в результате чего часть работы расширения опять превращается в теплоту 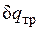 . Работа против внешней силы снова получается меньше, а возрастание энтропии — больше, чем в равновесном процессе с тем же количеством теплоты
. Работа против внешней силы снова получается меньше, а возрастание энтропии — больше, чем в равновесном процессе с тем же количеством теплоты 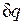 .
.
Если неравновесность вызвана теплообменом при конечной разности температур (температура газа Т меньше температуры источника T1), то возрастание энтропии рабочего тела 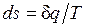 оказывается больше, чем
оказывается больше, чем 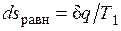 в равновесном процессе из-за снижения температуры газа. При том же положении поршня, т. е. заданном удельном объеме v, меньшей температуре газа соответствует меньшее его давление р. Соответственно меньше должна быть и уравновешивающая сила Р': Р'=p'F<P=pF. Работа расширения против этой силы
в равновесном процессе из-за снижения температуры газа. При том же положении поршня, т. е. заданном удельном объеме v, меньшей температуре газа соответствует меньшее его давление р. Соответственно меньше должна быть и уравновешивающая сила Р': Р'=p'F<P=pF. Работа расширения против этой силы 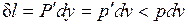 .
.
Итак, неравновесность всегда приводит к увеличению энтропии рабочего тела при том же количестве подведенной теплоты и к потере части работы. В общем виде это можно записать следующим образом:
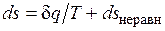 ;
; 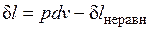 ,
,
Причем 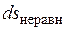 и
и 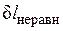 всегда положительны.
всегда положительны.
Ранее было показано, что для равновесных процессов справедливо соотношение 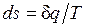 . Разобранный пример достаточно наглядно показывает, что в неравновесных процессах
. Разобранный пример достаточно наглядно показывает, что в неравновесных процессах 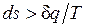 , если
, если 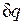 — количество подведенной к системе или отведенной от нее теплоты, а T — температура источника теплоты. Обе записи являются аналитическими выражениями второго закона термодинамики:
— количество подведенной к системе или отведенной от нее теплоты, а T — температура источника теплоты. Обе записи являются аналитическими выражениями второго закона термодинамики:
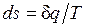 — в равновесных процессах;
— в равновесных процессах;
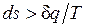 — в неравновесных процессах.
— в неравновесных процессах.
Для изолированных систем, которые по определению не обмениваются теплотой с окружающей средой 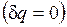 , эти выражения приобретают вид
, эти выражения приобретают вид
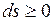 .
.
Если в адиабатно-изолированной системе осуществляются равновесные процессы, то энтропия системы остается постоянной.
Самопроизвольные (а значит, и неравновесные) процессы в изолированной системе всегда приводят к увеличению энтропии. Это положение представляет собой наиболее общую формулировку второго начала термодинамики для неравновесных процессов, известную под названием принципа возрастания энтропии.
Следует подчеркнуть, что последнее неравенство применимо только к изолированным системам. Если от системы отводится теплота, то ее энтропия может убывать, однако суммарное изменение энтропии системы и энтропии внешних тел всегда положительно (либо равно нулю, если в системе протекают равновесные процессы).
Когда изолированная система находится в состоянии с максимальной энтропией, то в ней не могут протекать никакие самопроизвольные процессы, потому что любой самопроизвольный процесс неравновесен и сопровождается увеличением энтропии. Поэтому состояние изолированной системы с максимальной энтропией является состоянием ее устойчивого равновесия, и самопроизвольные процессы могут протекать в изолированной системе лишь до тех пор, пока она не достигнет состояния равновесия.
ЛЕКЦИЯ 5
Дата добавления: 2016-11-04; просмотров: 1772;











