Координационные числа для ионов-комплексообразователей
| Координационное число | Ионы - комплексообразователи |
| Cu+, Aq+, Au+ Cu2+, Co2+, Au2+, Zn2+, Pb2+, Pt2, Al3+ Fe2+, Fe3+, Co3+, Ni2+, Al3+, Pt4+, Hb4+, Cr3+ |
В качестве лигандов выступают нейтральные молекулы (Н2О, NH3CO), ионы (NO2-. Cl-, Br-, OH- и др.). Каждый лиганд содержит определенное число атомов (донорных атомов), которые участвуют в непосредственном связывании с центральным атомом и образуют определенное число координационных связей (дентатность). Если лиганд образует одну связь с центральным атомом, то это монодентатный лиганд.К монодентатным лигандам относятся Сl-, J-, Br-, CN-, OH- и др. В случае монодентатных лигандов координационное число равно числу лигандов.
Бидентатный лиганд содержит два атома, которые образуют связь с центральным атомом. Например, этилендиамин (en) H2N – CH2 – CH2 – NH2 является бидентатным лигандом, в молекуле которого каждый из двух атомов азота образует одну связь с центральным атомом. В комплексном ионе [Cu(en)3]2+ координационное число меди равно 6, то есть в случае би- и полидентатных лигандов координационное число равно числу лигандов умноженному на дентатность К полидентатным лигандам относятся аминокислоты, белки пептиды, порфирины, которые называются еще биолигандами.
Заряд комплексного иона равен алгебраической сумме зарядов иона- комплексообразователя и лигандов:
Aq+ + 2 CN - 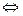
 [Aq(CN)2]- ; (+1 – 2= -1)
[Aq(CN)2]- ; (+1 – 2= -1)
Pt4+ + 6 Cl 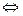 [PtCL6]2-. (+4 – 6= -2)
[PtCL6]2-. (+4 – 6= -2)
Входящие в состав комплексного иона электронейтральные молекулы не влияют на величину его заряда. Если лигандами являются только электронейтральные молекулы, то заряд комплексного иона равен заряду комплексообразователя. Например, в комплексных ионах [Aq(NH3)2]+ и [Cu(NH3)4]2+ заряд ионов равен заряду комплексообразователя.
Ионы, не вошедшие во внутреннюю координационную сферу. Образуют внешнюю координационную сферу. Ионами внешней сферы часто являются ионы щелочных и щелочноземельных металлов, ионы аммония и анионы.
Дата добавления: 2016-11-04; просмотров: 2609;











