При проведении необратимого цикла изменение энтропии больше нуля или энтропия системы увеличивается.
Объединяя формулы (4) – (8), получим
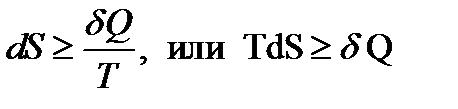 (9)
(9)
От знака неравенства в (9) логично избавиться. Эта идея переводит нас из области науки в область инженерных задач: условие (9) можно использовать для описания равновесий, самопроизвольно устанавливающихся в технических системах.
Приращение энтропии в необратимом процессе происходит вследствие потерь работы и, очевидно, для получения от необратимого процесса такого же количества работы, как при обратимом процессе, необходимо от источника энергии взять большее количество теплоты на величину этих потерь:
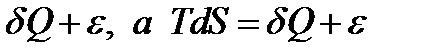 (9*)
(9*)
где ε – мера необратимости, представляющая собой величину, большую или равную нулю (ε ≥ 0). Для обратимого процесса ε = 0.
Выражение (9*) позволяет объединить 1-й и 2-й законы в одном выражении:
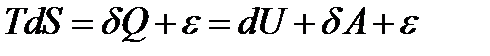 (10)
(10)
Для обратимого процесса (ε = 0)
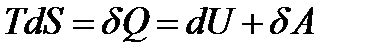 (11)
(11)
Таким образом, изменение энтропии может определять условия обратимости или направленность самопроизвольного процесса в термодинамической системе.
Для конкретизации этого утверждения, применим уравнение (10) к изолированной термодинамической системе. В качестве примера такой системы возьмем моль идеального газа (уравнение состояния pv=RT). Для условия постоянства внутреннней энергии U = const (для идеального газа T=const) и постоянства объема v=constформула (10) преобразуется к виду:
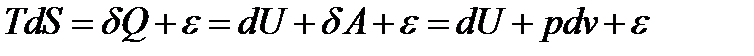 (10*)
(10*)
или dS = ε/T> 0 в случае необратимого процесса. Если необратимые процессы в системе закончились и ε → 0, то
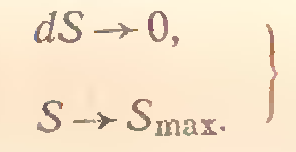
(12) - первое аналитическое описание возможности
протекания самопроизвольного процесса
Дата добавления: 2021-02-19; просмотров: 416;











