Закон термодинамики
Впервые этот закон сформулирован в 1842 году Ю. Майером:
«Энергия не исчезает и не возникает из ничего, а только превращается из одного вида в другой в строго эквивалентных соотношениях». Эта формулировка может быть конкретизирована:
«В изолированной системе внутренняя энергия постоянна, т.е. ∆U = 0»;
«Если теплотаQподведена в закрытую систему, то эта энергия расходуется на увеличение внутренней энергии системы ∆Uи на совершение системой работы против внешних сил окружающей среды, или
в общем случае замкнутой системы обмен энергией с окружающей средой возможен,а энергия Q будет распределяться на повышение запасов внутренней энергии и работу А, которую система может совершать:
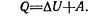
или для малых величин 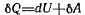 .
.
В математическом выражении первого закона термодинамики энергия Q, полученная из окружающей среды имеет знак «+», а отданная в окружающую среду «-».
Приращение внутренней энергии имеет знак «+», уменьшение – «-».
А – внешняя работа, совершаемая системой «+», совершаемая над системой «-». Выразим это взаимодействие через характеристики ТС.
1) При изохорическом процессе (V=const)
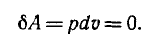
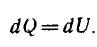
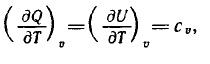
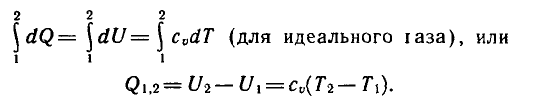
2) В изотермическом процессе (T=const)
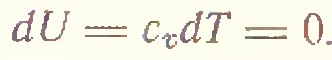
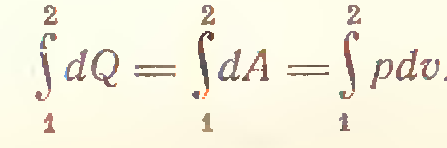
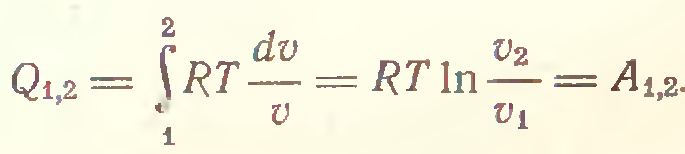
3) Адиабатический процесс (δQ = 0)
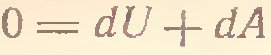
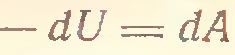
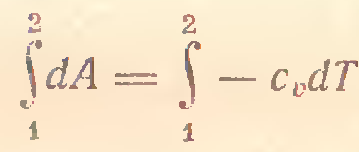
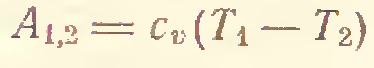
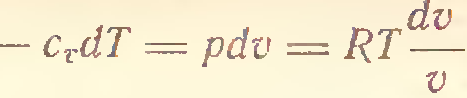
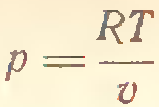
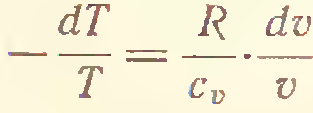
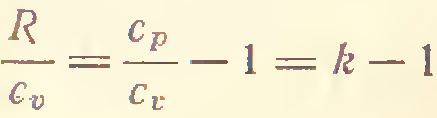
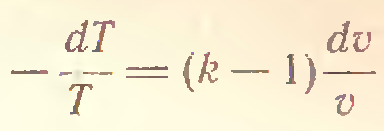
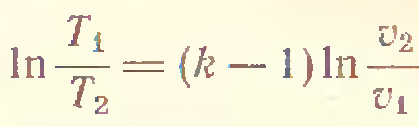


4) P=const
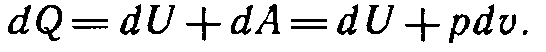
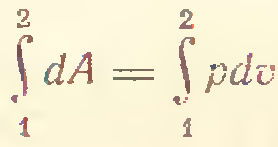
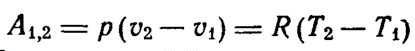
В изобарно-изотермических условиях имеем:
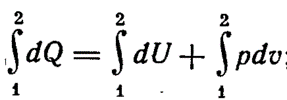
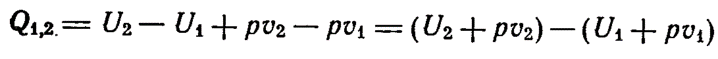
Сумму внутренней энергии системы и произведения объема на давление (U+pV) называют энтальпией (H)или теплосодержанием.
Энтальпия - термодинамическая функция, характеризующая энергетическое состояние системы в изобарно-изотермических условиях.
Теплота, полученная системой при р,Т = const, равнаприращению энтальпии системы ∆H :
Q = Нкон- Ннач = ∆H
В условиях изобарно-изотермического процесса разность значений ∆Hравна внутренней энергии и внешней работе, которая необходима для перевода системы из одного состояния в другое.
При разработке и реализации того или иного химического процесса приходится решать две крупные проблемы. Первая связана с возможностью протекания химической реакции при определенных условиях (Т, р и др) с целью получения желаемого продукта. Термодинамический подход указывает на принципиальную возможность самопроизвольного протекания реакции. Второй проблемой является скорость самопроизвольного процесса.
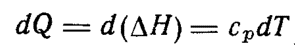
! 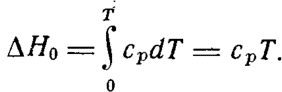
ПриТ=0 ∆Н=∆Н0> 0.
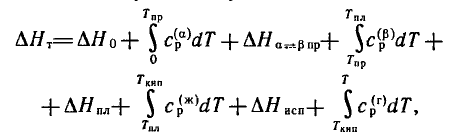
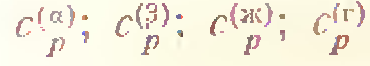 - теплоемкости, рассчитанные на 1 моль вещества, зависимость от температуры которых меняется при переходе вещества из одного состояния в другое.
- теплоемкости, рассчитанные на 1 моль вещества, зависимость от температуры которых меняется при переходе вещества из одного состояния в другое.
При осуществлении разнообразных физико-химических процессов пользоваться абсолютными значениями энтальпий, вычисленных от 0К и неудобно, и ненужно: можно выбрать любой удобный уровень отсчета.Для удобства расчетов приняты стандартные условия:количество вещества - 1 моль;
температура - 298,16K=250C;
давление - 760 мм рт. ст. (1атм) = 191325 Па = 1,013*105Па;
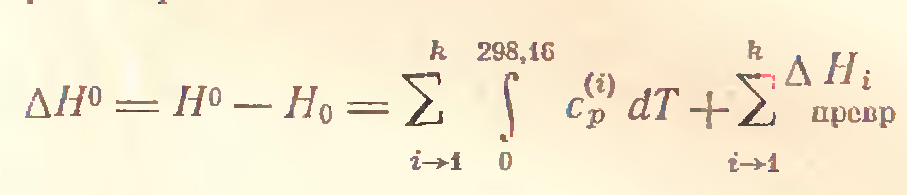
Для оценки энергетического состояния веществ используются значения стандартных энтальпий образования этих веществ, обозначаемые ∆Н0(вещество(агрегатное состояние)), кДж/моль.
Дата добавления: 2021-02-19; просмотров: 651;











