Термодинамические функции
Энергия. Работа. Теплота. Теплоемкость.
Энергия - внутренняя, энтальпия, энергия Гиббса, энергия Гельмгольца.
Энергия- мера способности системы совершать работу.
Различают кинетическую энергию (энергию движения) и потенциальную энергию (энергию положения и взаимодействия частиц) системы.
Внутренняя энергия – энергия всех положений частиц системы.
РаботаА – любая макрофизическаяформа передачи энергии, связанная с перемещением масс макроскопических размеров под действием каких-либо сил.
Теплота, количество теплоты —энергетическая характеристика процесса теплообмена, измеряемаяколичеством энергии, которое получает или отдает в этом процессетело или система. Единица измерения (в СИ- джоуль (Дж), но до настоящего времени мы пользуемся калориметрами.
Качественно и количественно иной формой передачи энергии является теплотаQ. Теплота – любая микрофизическая форма передачи энергии.
Для количественной оценки теплоты, которую получает телопри нагревании, вводится функциятеплоемкость.
Теплоемкостью называется количество теплоты, соответствующееизменению температуры единицы количества вещества на1°С.
Количество теплоты, необходимое для нагревания 1 г веществана 1°С, называетсяудельной теплоемкостью.
Количество теплоты,необходимое для нагревания 1 моля вещества на 1°С называетсямолярной теплоемкостью.
Смол= Суд*М
изобарическая теплоемкость – Cp
изохорическая теплоемкость – Cv
Cp= Cv+R – формула Майера
Следует различать среднюю теплоемкость для интервала температури истинную при данной температуре, соответствующуюбесконечно малому приращению теплоты, деленному на бесконечномалое приращение температуры.
Истинная теплоемкость:
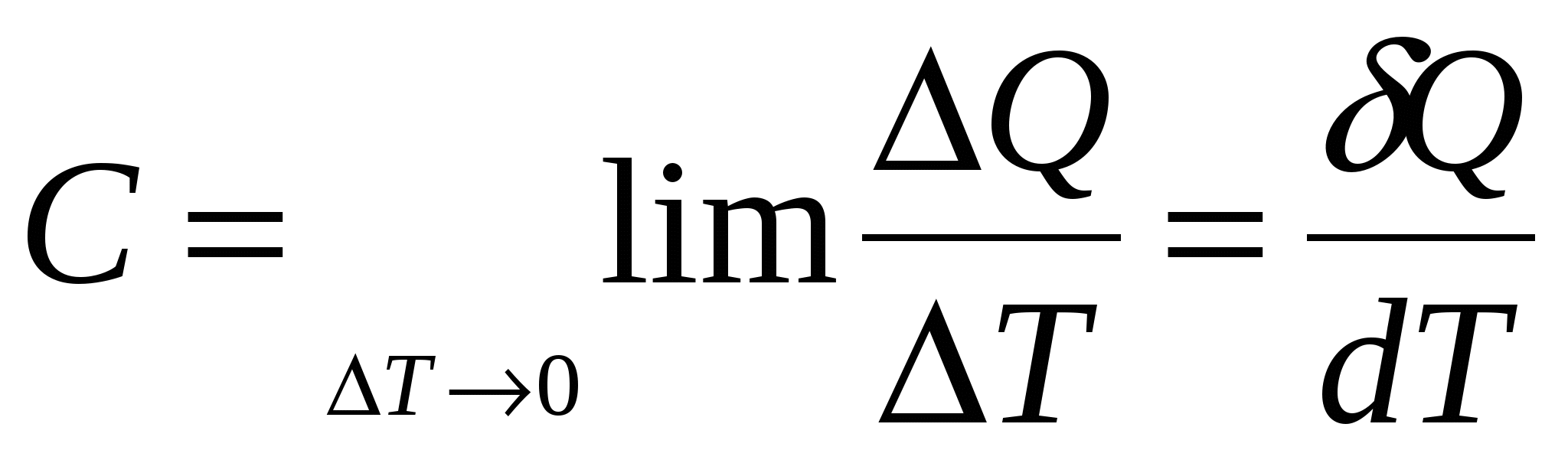
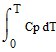 Внутренняя энергияU=
Внутренняя энергияU=
ЭнтальпияH=
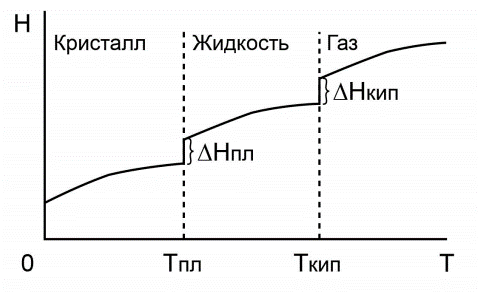
Термодинамически равновесное состояние характеризуется постоянством всех свойств во времени в любой точке системы и отсутствием потоков вещества и энергии в системе.Для выведения системы из этого состояния необходим обмен энергией или веществом между системой и окружающей средой.
Стационарное состояние системы характеризуется постоянством свойств во времени, которое поддерживается за счет непрерывного обмена веществом, энергией и информацией между системой и окружающей средой.
Важно различать состояния термодинамического равновесия и химического равновесия; последнее всегда имеет динамический характер, так как достигается в результате выравнивания скоростей обратимых процессов.
Дата добавления: 2021-02-19; просмотров: 409;











