Теория адсорбции Лангмюра
Интенсивность процесса адсорбции оценивается количеством (объемом или массой) адсорбированного вещества. Процесс адсорбции можно рассматривать во времени, определяя время, необходимое для адсорбции некоторого количества вещества. При адсорбции газообразного вещества на твердом адсорбенте объем адсорбированного вещества зависит от давления газа р и температуры Т (для смеси газов р - парциальное давление).
Классический метод изучения адсорбции заключается в установлении зависимости между количеством адсорбированного газа, температурой и давлением. Обычно при исследовании адсорбции поддерживают постоянную температуру и по форме полученных изотерм V(p) судят о характере адсорбции.
По Фрейндлиху объем адсорбированного вещества
Vadc = kp п(3.1)
где к, п — константы; р - давление газа (парциальное давление). Значение п лежит в пределах 0,1- 0,9, оно возрастает с увеличением температуры, стремясь к единице. Значение к изменяется в зависимости от вида адсорбента и адсорбата.
Ограниченность числа адсорбционных центров при любом виде адсорбции должна приводить к адсорбционному насыщению, т.е. величина адсорбции при повышении давления не может неограниченно возрастать, а должна стремиться к некоторому пределу. Это стремление к пределу выражено в теории адсорбции Лангмюра (1916 г.). В основе этой теории лежат три положения.
Адсорбент представляет для адсорбата ограниченное число независимых адсорбционных мест. В каждом месте может адсорбироваться одна молекула. Такие места могут существовать и при химической и при молекулярной адсорбции. В первом случае это отдельные ненасыщенные валентности поверхностных атомов адсорбента, во втором - это площадки на поверхности или «пещерки» внутри адсорбента. Независимость мест означает, что адсорбция на одном месте не изменяет условия адсорбции на другом. Ж. Ленгмюр предположил, что на поверхности может образоваться только мономолекулярный слой адсорбированного вещества, потому что поле поверхностных сил имеет слишком маленький радиус действия, чтобы удерживать мультимолекулярный слой. Место во втором слое не может быть заполнено, если не заполнено соответствующее место в первом слое.
2. Все адсорбционные места полагаются одинаковыми. В случае, если адсорбция осуществляется на некоторой поверхности, то это положение означает однородность поверхности.
3. Между адсорбированными молекулами отсутствует взаимодействие.
Лангмюр предположил, что при равновесии скорость десорбции молекул ↑Vравна скорости адсорбции ↓V.
Влияние различных факторов на процессы адсорбции и хемосорбции
Во всех теориях адсорбции не учитываются два важнейших фактора: вид адсорбата (химическое строение адсорбируемых молекул) и вид адсорбента (структура поверхности твердого тела). Обычно предполагают, что вся поверхность однородна с энергетической точки зрения и что существует одинаковая вероятность адсорбирования молекул в любом месте поверхности. Такие предположения неверны.
X. Тейлор выдвинул концепцию активных центров, т.е. таких активных мест на поверхности, в которых происходит адсорбция. В теории мульти-плетов А.А. Баландина учтен фактор геометрического соответствия между расположением атомов в кристаллографической решетке поверхности твердого тела и строения хемосорбированных молекул. Вместе с принципом энергетического соответствия эта теория справедлива для идеальной кристаллической решетки.
Реальные кристаллы имеют множество разнообразных дефектов, которые принципиально изменяют хемосорбционную способность адсорбентов. Кристаллическая решетка твердого тела имеет макродефекты (включения, трещины) и микродефекты, к которым относятся только отдельные узлы решетки и их окрестности. Дефекты можно разделить на геометрические (вакансия, атом между узлами решетки и пр.), электрические (ненормальные заряды ионов в решетке) и химические (инородные атомы, примеси и т.п.). Геометрические дефекты наименее стойкие, потому что при сравнительно небольших энергетических затратах можно упорядочить кристаллическую решетку. Дефекты в структуре реальных кристаллов чаще всего возникают в условиях кристаллизации, особенно при протекании ее с большой интенсивностью, при температуре значительно ниже температуры плавления. Химические дефекты возникают, когда в процессе кристаллизации имеется возможность адсорбции посторонних веществ. При таких условиях кристаллизации получают очень активные поверхности.
Природа адсорбированных сил в случае адсорбции атомов на металлах и полупроводниках имеет специфический характер. Электроны адсорбированных атомов взаимодействуют в этих системах с коллективом электронов адсорбента. В случае полупроводников важно, является ли адсорбированный атом акцептором или донором электронов. В первом случае электрон из заполненной зоны переходит на атом, во втором электрон атома переходит в зону проводимости.
Особенное место среди хемосорбционных теорий занимает квантово-механическая теория Ф.Ф. Волькенштайна(1947 г.). Она касается хемосорбции на полупроводниках и имеет большое значение для объяснения проблем хемосорбированных слоев при смазывании поверхности металлов смазочными материалами, потому что поверхность металла обычно покрыта пленками оксидов, т.е. полупроводниками. Взаимоотношение адсорбированных атомов, связанных различными видами связей, зависит от толщины кристаллов полупроводника, на котором происходит хемосорбция. Если толщина кристаллов полупроводника менее 0,1 мкм, то концентрация свободных электронов в полупроводнике, как и взаимоотношение различных видов связей, которыми связаны с полупроводником адсорбированные атомы, не зависит от внутренних свойств кристалла, наличия примесей в пространственной решетке полупроводника, но зависит от количества адсорбированных атомов.
Поверхностные свойства кристаллов зависят от их внутренних свойств, если их толщина превышает 0,1 мкм. Хемосорбция связана с переходом электрона с адсорбента на адсорбат и наоборот. Количество адсорбированных атомов, каждый из которых отдает или принимает определенное количество электронов, связано с электронными свойствами адсорбируемых молекул и адсорбента. При достаточно низких температурах подвижность механических и химических дефектов решетки мала. В этом случае увеличение или уменьшение количества электронов и дырок, происходящее в процессе хемосорбции, ограничено поверхностным слоем кристалла толщиной 0,1 мкм, называемым граничным слоем.
Избежать формирования хемосорбированных слоев при контакте металлов с активными газовыми средами чрезвычайно трудно. При контакте с атмосферой важнейшими с точки зрения развития адсорбции компонентами среды являются азот, кислород, водород. Эти компоненты присутствуют в виде двухатомных молекул, а не отдельных атомов. Для протекания хемосорбции необходимы прежде всего диссоциация молекул и наличие соответствующей свободной энергии.
При взаимодействии атомов газа с поверхностью металла происходит образование хемосорбционной связи. Энергия хемосорбционного взаимодействия значительно выше энергии физической адсорбции. Ее значение определяется двумя факторами - свойствами поверхности металла и природой адсорбата.
Значение энергии адсорбции чрезвычайно важно для специалистов по трению и изнашиванию, т.к. позволяет рассчитать прочность хемосорбционной связи, в значительной мере определяющей долговечность узлов трения. При сварке и других процессах, связанных с образованием соединения материалов, эта величина необходима для расчета параметров технологического процесса.
Лангмюровская теория адсорбции является полезной абстракцией, передающей важные черты явления. Однако уже вскоре после ее формулировки был обнаружен ряд противоречащих ей фактов. Так, теплота адсорбции в соответствии со вторым и третьим положениями теории Лангмюра не должна зависеть от степени заполнения. Однако в действительности теплота адсорбции падает по мере заполнения.
Наиболее естественное развитие лангмюровской картины заключается в отказе от второго положения Лангмюра: в учете неоднородности поверхности. Т.к. адсорбционные места работают независимо, то общая адсорбция может быть найдена суммированием величин адсорбции на определенных группах мест. Место характеризуется теплотой адсорбции Q и, следовательно, величиной b. Обозначим число мест с теплотой Qi, буквой zi. Тогда при концентрации С на этой группе мест адсорбируется Гi молекул:
Гi = zi bi C / 1+ bi C (3.2)
Общая величина адсорбции Г равна сумме этих величин, т.е.
Г = Σ ( zi bi C / 1+ bi C) (3.3)
Для проведения суммирования необходимо знать зависимость zi от bi т.е. характеристику распределения центров.
Согласно рассмотренной концепции неоднородной поверхности, теплота адсорбции должна падать с заполнением, так как молекулы сначала адсорбируются на местах с большей теплотой адсобции. Это падение, однако, может иметь место и на однородной поверхности из-за взаимодействия адсорбированных молекул.
Известны и другие теории адсорбции, основанные на различных предпосылках. Можно выделить одно- и многослойную адсорбцию. Однослойная адсорбция может не учитывать взаимодействия между адсорбированными молекулами (изотерма Ленгмюра и ее аналоги, изотерма Вольмера) или учитывать (двухмерная конденсация по Харкинсу и Джуру). Многослойная адсорбция объясняется с помощью теорий потенциала, поляризации и др.
Применяемость отдельных теорий адсорбции зависит от того, какое вещество адсорбируется и на каком адсорбенте.
Процесс хемосорбции на поверхности металла продолжается до достижения вполне определенной концентрации адсорбата, при которой наступает насыщение. Реальные поверхности металлов покрыты хемосорбироваиными газами, а в кислородсодержащей среде, как правило, наблюдается и их окисление. В атмосфере помимо кислорода содержатся и другие компоненты, но на поверхности чаще всего обнаруживается кислород.
Лекция 4. Адсорбция из раствора
Если в какой-нибудь жидкости 1 растворить вещество 2, получится раствор вещества 2 в растворителе 1 (рис. 4.1). В таком растворе оба вида молекул могут свободно перемещаться, действуя при этом силами притяжения на соседние молекулы. Если взаимодействие между молекулами 1 сильнее, чем между молекулами 2, то молекулы 1 будут сильнее втягиваться в глубь жидкости, чем молекулы 2, имеющие в этом случае тенденцию к концентрации на поверхности раствора. Поэтому не будет равномерного распространения молекул 1 и 2 во всем растворе. Такого рода увеличение концентрации молекул 2 на поверхности является примером положительной поверхностной концентрации. Если молекулы вещества 2 взаимодействуют слабее, чем молекулы растворителя 1, то они будут скапливаться внутри раствора и их концентрация на поверхности будет меньше, чем внутри жидкости. Это случай отрицательной адсорбции.
Вещество, имеющее тенденцию к адсорбции на поверхности раствора и снижению поверхностного натяжения, называется поверхностно-активным веществом (ПАВ). Стремлению к концентрации молекул ПАВ на поверхности раствора противодействуют силы диффузии и тепловое движение. Если силы, приводящие к накоплению молекул на поверхности, велики, а противодействующие силы (тепловое движение, диффузия) малы, то молекулы ПАВ могут образовать на поверхности плотный мономолекулярный адсорбционный слой.
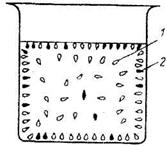
Рис. 4.1. Положительная поверхностная адсорбция из раствора.
Зависимость поверхностного натяжения раствора от концентрации ПАВ выражается формулой Шишковского
σo -σr = a Lg(1- bc ) (4.1)
где σo -σr - уменьшение поверхностного натяжения за счет ПАВ; σr - поверхностное натяжение раствора; с - концентрация ПАВ в растворе; а,b - постоянные.
На поверхности раствора молекулы ПАВ определенным способом ориентированы по отношению к поверхности в зависимости от их химического строения и пространственного распределения зарядов (дипольный момент). Если молекулы вытянутые, имеют цепочное строение, то, как правило, ось цепочки молекулы перпендикулярна к поверхности жидкости. Если молекула кольцевая или со сложным смешанным строением (цепочно-кольцевым), расположение молекул на поверхности может быть иным.
Когда поверхность твердого тела вступает в контакт с раствором, то полем своих поверхностных сил онa прежде всего воздействует на молекулы поверхностного слоя раствора, т.е. на молекулы ПАВ. При контакте раствора с твердым телом молекулы ПАВ даже при очень низкой концентрации их в растворе имеют наибольшие шансы адсорбции на поверхности твердого тела вследствие их большой концентрации в ПС, а также потому, что они обычно являются полярными (рис. 4.2).
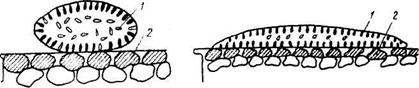
а б
Рис. 4.2. Капля раствора 1 на поверхности твердого тела 2: а - капля с большой связностью; б - капля с малой связностью.
Наибольшей способностью к адсорбции обладают поверхностно-активные вещества (ПАВ), молекулы которых ориентируются при адсорбции перпендикулярно к поверхности (например, органические кислоты, их металлические мыла, спирты и смолы). Вода проявляет большую адсорбционную активность к резине и антифрикционным пластмассам. Характерной особенностью ПАВ является несовпадение центров тяжести положительных и отрицательных зарядов в их молекулах даже в изолированном состоянии. В их молекулах как бы существуют два противоположных пространственно разделенных заряда. Такие полярные молекулы притягиваются и удерживаются поверхностью твердого тела.
Молекулы веществ, адсорбированных на поверхности твердого тела, обладают способностью перемещаться по поверхности из областей, где имеется их избыток, в места, где их недостаточно для полного покрытия поверхности. Подвижность адсорбированных молекул зависит от вида адсорбции - физической или химической. При химической адсорбции (хемосорбции) полярные концы молекул, связываясь с поверхностью тела, образуют в ней монослой, сходный с химическим соединением. Хемосорбция, в отличие от физической адсорбции, носит избирательный характер; она протекает с большой интенсивностью в местах нарушения регулярности кристаллической решетки. Часто физическая и химическая адсорбции протекают одновременно, но одна из них является преобладающей Так, адсорбция жирных кислот на металлических поверхностях при нормальной температуре носит в основном физический характер, а при повышенной температуре -химический.
Силы взаимодействия между молекулами ПАВ и металлической поверхностью различны по природе и зависят как от природы веществ, так и от металла. Наиболее прочной связью обладают молекулы с активной карбоксильной группой. Существование адсорбированного слоя определяется температурой. Адсорбированный слой ПАВ является мономолекулярным. Искусственным путем можно образовать многомолекулярную пленку, в которой каждый слой будет состоять из одинаково ориентированных молекул. К металлу прикрепляются активные молекулы первого ряда, затем - молекулы второго ряда и так далее. Так получают пленки в 1000 молекулярных слоев.
Большинство жидких сред с цепными молекулами (удлиненной формы) образуют на границе с металлической поверхностью особую структуру. Минеральные и растительные масла, а также соединения, входящие в состав животных жиров, являются представителями таких сред. Даже масла, состоящие из углеводородов полно насыщенных рядов СnН2n или CnН2n+2 , имеющие неполярные молекулы (например, неочищенное вазелиновое масло), образуют на металлах тонкую пленку из отдельных слоев с ориентацией молекул в них перпендикулярно к поверхности металла. Адсорбция в данном случае происходит под влиянием поляризации неактивных углеводородных молекул электрическим полем металлической поверхности. Однако в слоях встречаются незаполненные места. Прочность и устойчивость такой адсорбированной пленки малы. Достаточно, однако, в состав такого масла добавить незначительное количество (порядка 0,1%) ПАВ, чтобы образовался адсорбированный монослой поверхностно-активных молекул (рис. 4.3), способный сообщить расположенным выше слоям масла ориентацию. В смазочных маслах, имеющих ПАВ, на границе с поверхностью также образуется адсорбированный слой большей или меньшей прочности.
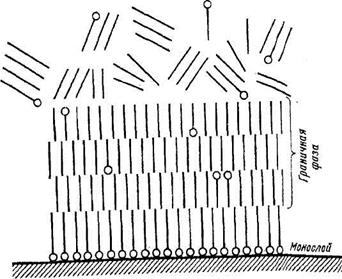
Рис. 4.3. Схема адсорбированного монослоя полярных молекул и ориентация неполярных молекул
Таким образом, жидкости с молекулами большой длины, содержащие в растворе ПАВ, образуют над монослоем полярных молекул граничный слой, в котором молекулы расположены не беспорядочно, как в объеме жидкости, а правильно ориентированы. Граничные слои находятся в особом агрегатном состоянии, имея квазикристаллическую структуру. Это особая фаза жидкости - граничная фаза. При некоторой температуре пленка квазикристаллической структуры как бы расплавляется: силы продольной когезии между молекулами исчезают, происходит дезориентация адсорбированных молекул и теряется способность смазочного материала к адсорбции. Температура дезориентации на химически неактивных металлах для жирных кислот близка к температуре их плавления (40-80°С), а на химически активных металлах - к температуре плавления их металлических мыл (90-150°С).
При хемосорбции адсорбируемые молекулы или атомы вступают в химическое взаимодействие с частицами (молекулами, атомами, ионами) твердого тела, расположенными в ПС. Энергия хемосорбции намного (на несколько порядков) больше энергии физической адсорбции. Молекулы (частицы) веществ, способных участвовать в хемосорбции, вытесняют с поверхности твердого тела молекулы, участвующие только в физической адсорбции. Поэтому на поверхностях там, где это возможно, возникают хе-мосорбционные пленки в простейшем и наиболее распространенном случае это пленки оксидов.
Поглощаемое при абсорбции вещество со временем может равномерно распределиться в объеме тела.
Способность поверхностно-активных элементов предпочтительно концентрироваться вблизи раздела фаз используется в металлургии и в сварке для регулирования ряда процессов и получения желаемых свойств металла.
+
Дата добавления: 2016-10-26; просмотров: 3568;











