Лекция 2. Общие сведения о физической адсорбции и хемосорбции.
В большинстве случаев поверхности твердых тел не являются атомарно чистыми. Они покрыты слоями оксидов или других видов пленок, возникающих при взаимодействии с окружающей средой вследствие физической или химической адсорбции. Под окружающей средой подразумевается либо обычная атмосфера, либо специально созданная среда, например, смазочный материал.
Поверхность кристалла, полученная путем его раскалывания или нагревания при достаточно высоких температурах в сверхвысоком вакууме (для десорбции имевшегося адсорбционного слоя) вначале является чистой. Однако далее поверхность в присутствии газовой атмосферы адсорбирует атомы или молекулы из окружающей среды. В результате образуется моно - или полиатомное или же молекулярное покрытие.
Адсорбция - это частный случай сорбции, которая объединяет и поверхностное поглощение - адсорбцию, и объемное поглощение вещества жидкостью или твердым телом - абсорбцию. Адсорбция происходит на границе фаз и характеризуется различной концентрацией составляющих одной из фаз в ПС и в глубине этой фазы (рис. 2.1). Если в ПС молекул одной составляющей больше, чем внутри фазы, то имеет место положительная адсорбция, в противном случае - отрицательная адсорбция, например адсорбция газа или жидкости на поверхности твердого тела, на которой существует поле сил, зависящее от его химического строения. При соприкосновении поверхности твердого тела с молекулами окружающего его газа или жидкости в результате взаимодействия молекулы газовой (или жидкой) фазы приклеиваются к поверхности твердого тела.
Твердое тело, на котором адсорбируются молекулы, называется адсорбентом. Вещество, адсорбированное на адсорбенте, называется адсорбатом. Процесс обратный адсорбции, т.е. освобождение адсорбированных молекул, называется десорбцией.
Если адсорбат десорбируется с поверхности твердого тела растворителем, то этот процесс называется элюированием, а растворитель, вымывающий адсорбат, - элюентом.
Адсорбция газов может возникать под действием молекулярных сил, вызывающих отклонения от законов идеальных газов и явление конденсации. Этот тип адсорбции часто называют молекулярной, или адсорбцией Ван-дер-Ваальса. Присоединение молекул к поверхности межмолекулярными (ван-дер-ваальсовыми) силами называется физической адсорбцией, а химическое соединение молекул с поверхностью - хемосорбцией.Химическая адсорбция (хемосорбция) вызывается силами химического сродства. Адсорбирующееся вещество (адсорбат) образует при этом поверхностные соединения. При химической адсорбции имеет место обмен электронами между адсорбирующей молекулой и адсорбентом (энергия связи более 1 эВ). Часто скорость химической адсорбции мала при низкой температуре и растет с температурой. Это связано с тем, что процесс взаимодействия между молекулами газа и атомами поверхности твердого тела характеризуется активационным барьером. Химическую адсорбцию рассматриваемого типа часто называют активированной.
Оба эти вида адсорбции нельзя резко отделить друг от друга, т.к. они взаимосвязаны. Адсорбционные процессы можно охарактеризовать путем определения изотерм адсорбции. Под изотермой адсорбции понимают зависимость количества адсорбированного вещества от давления газа или пара (или от концентрации растворенного вещества при адсорбции из раствора) при постоянной температуре. Существование процесса адсорбции можно доказать экспериментально, определяя, например, убыль объема газовой фазы над поверхностью твердого тела волюмометрическим методом или увеличение массы адсорбирующего вещества с помощью взвешивания. Применяют также измерения проводимости.
При физической адсорбции молекулы адсорбата ВС охраняют свою индивидуальность, а силы, ответственные за адсорбцию, аналогичны ван-дер-ваальсовым силам в реальных газах. При химической адсорбции адсорбируемая молекула образует химическое соединение с твердым телом ABC (рис. 2.1, а) благодаря силам обменного взаимодействия, включающим в себя в той или иной мере ионное взаимодействие. Двум видам взаимодействия соответствуют различные кривые потенциальной энергии U(x). Кривая 2 на рис. 2.1, а характеризует ван-дер-ваальсову физическую адсорбцию, а кривая 1, обладающая более глубоким минимумом, - химическую адсорбцию. Равновесное расстояние хг, определяющее положение минимума потенциальной энергии, при физической адсорбции всегда больше х». Пересечение кривых 1 и 2 приводит к образованию потенциального барьера, высота которого часто отождествляется с энергией активации.
При повышении температуры физическая адсорбция может схематически переходить в хемосорбцию, если тепловая энергия к0Т > ∆u. Схематически это показано на рис. 2.1, б. При низких температурах изобара V(t) описывает физическую адсорбцию, когда количество (объем) адсорбированного газа уменьшается с ростом температуры. При несколько более высоких температурах количество адсорбированного газа увеличивается, т.к. начинается хемосорбция, но затем вновь падает. Адсорбция в области 1обратима, а в области 2 необратима, при охлаждении процесс переходит из области 3 в область 4.
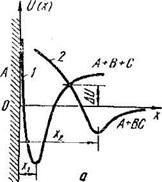
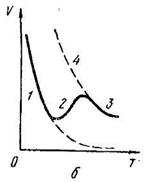
Рис. 2.1. Кривые потенциальной энергии системы адсорбент-молекулы ВС (а) и изобара (б) реакции на поверхности
Принципиальное значение для процесса адсорбции на чистой поверхности металлов имеет факт существования газа свободных электронов. Неравномерность распределения электронов вблизи поверхности связана с особенностями их движения, в частности с эмиссией электронов с поверхности. Эмиссия приводит к обеднению приповерхностных слоев электронами и возникновению двойного электрического слоя (рис. 2.2). При этом у свободной поверхности образуется область отрицательного заряда, а в приповерхностном объеме материала - положительного. Фактически можно говорить о возникновении электрических диполей. Взаимодействие адсорбирующейся молекулы с двойным электрическим слоем обусловливает физическую адсорбцию. Оно носит название ван-дер-ваальсового взаимодействия и характеризуется небольшой энергией связи.
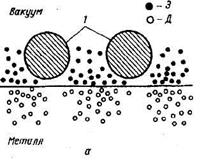
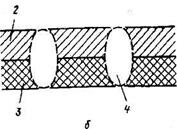
Рис. 2.2 . Схема распределения электронов в приповерхностных слоях металла при физической адсорбции молекул: а - схема физической адсорбции: 1 - адсорбированные молекулы; Э - электроны; Д - дырки; б - распределение заряда у поверхности: 2 - отрицательно заряженный слой; 3 - положительно заряженный слой; 4 - воображаемый диполь
Адсорбция - динамический обратный процесс, т.е. молекулы адсорбата не навсегда связаны с поверхностью адсорбента, а подвергаются непрерывному обмену с молекулами газовой фазы. При адсорбционном равновесии количество молекул, оседающих на поверхности в единицу времени, равно количеству молекул, переходящих в газовую фазу. В результате количество молекул на поверхности остается постоянным.
Для физической адсорбции характерны легкая обратимость процесса адсорбции (десорбция) и заменяемость уже имеющегося адсорбционного слоя другим газом (обменная адсорбция). Причем газ на данной кристаллической поверхности адсорбируется тем легче, чем выше его точка кипения, т.е. чем легче он превращается в жидкость. Например, имеющийся адсорбционный слой водорода, азота или окиси углерода очень легко может быть вытеснен молекулами СО2 или некоторыми углеводородами. По той же причине инертные газы проявляют очень слабую склонность к адсорбции или она совершенно отсутствует. Легкая адсорбируемость газов с высокой точкой кипения может быть доказана экспериментально. Если в вакууме или в атмосфере инертного газа изготовляется активный (пирофорный) железный порошок и его выставляют на воздух, то он самопроизвольно сгорает. Если же на порошке железа предварительно адсорбируют углекислый газ СО2, то последующая реакция с кислородом или не идет или ослабляется.
Обычно молекула адсорбата на некоторое время задерживается на поверхности адсорбента. Поэтому поверхность всегда (по крайней мере, частично) покрыта слоем адсорбата. Толщина слоя адсорбата растет с увеличением среднего пребывания молекул на поверхности, которое зависит от сил взаимодействия между поверхностью и прилегающими к ней молекулами.
Для частиц, расположенных в ПС, характерна нескомпенсированность связей, поэтому частицы, расположенные на поверхности, обладают сильной адсорбционной способностью. Молекулы воздуха (адсорбата), находящиеся в хаотическом тепловом движении и при обычных температурах обладающие значительными скоростями, приближаясь к поверхности твердого тела (адсорбента) на достаточно близкое, сравнимое с радиусом межмолекулярных взаимодействий расстояние, притягиваются к ней. Если угол между траекторией движения молекулы и перпендикуляром к поверхности в точке соприкосновения ее с поверхностью твердого тела (угол падения) достаточно велик, то есть нормальная составляющая скорости движения молекулы невелика, то молекула остается в поле поверхностных сил (адсорбируется на поверхности твердого тела). Если угол падения мал, то молекула подходит к поверхности твердого тела, как бы прилипает к ней, а затем отскакивает от нее. Скорость отскока зависит от скорости, с которой подходит молекула, и температуры поверхности твердого тела. При физической адсорбции проявляются только межмолекулярные взаимодействия и молекулы адсорбата сохраняют свою индивидуальность. Физическая адсорбция является обратимой. Наряду с адсорбцией происходит десорбция молекул, которые в результате тепловых или иных процессов уходят с поверхности твердого тела. В течение определенного промежутка времени между адсорбцией и десорбцией наступает динамическое равновесие. Это время зависит от давления газов и паров над поверхностью твердого тела и обычно составляет 10-10 ...10-5 с. При обычном атмосферном давлении на поверхности твердого тела, помещенного в воздушную или иную газовую среду, мгновенно возникают пленки адсорбируемых молекул. При очень низком давлении равновесное состояние достигается за несколько часов. В газовых смесях в адсорбированных слоях наблюдается перераспределение молекул. Наиболее активные сильно адсорбирующиеся молекулы вытесняют с поверхности твердого тела слабо адсорбирующиеся.
Адсорбция молекул приводит к уменьшению поверхностной энергии. В результате этого в окружающую среду выделяется некоторое количество энергии, называемое энергией адсорбции, следовательно, адсорбция - изотермический процесс. Теплота физической адсорбции примерно равна теплоте конденсации адсорбата(обычно меньше 41,8 Дж/моль). Теплота хемосорбции может достигать 627 Дж/моль.
Измерение величины адсорбции газов на твердом адсорбенте может проводиться двумя группами методов - статическими и динамическими. В статических методах изучается равновесие неподвижной системы газ - адсорбент. В динамических методах смесь изучаемого и мало адсорбирующегося газа (например, гелия) пропускается через слой адсорбента.
Теплота адсорбции газа на твердом адсорбенте всегда положительна. Поэтому в соответствии с требованиями термодинамики равновесное значение адсорбированного количества всегда падает с ростом температуры. Молекулярная адсорбция в соответствии с этим всегда уменьшается с ростом температуры при постоянном давлении. В случае активированной адсорбции имеют место более сложные соотношения. На рис. 2.3 схематически показана изобара адсорбции для случая, когда протекают
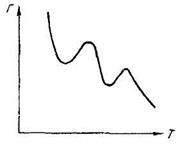
Рис. 2.3. Изобара адсорбции для случая активированной адсорбции
активированные процессы. При низкой температуре с ее возрастанием падает величина адсорбции. Адсорбция при этом является молекулярной. Химическая активированная адсорбция при этих температурах не осуществляется из-за медленности процесса, хотя равновесие для этого процесса сдвинуто в сторону адсорбции. При повышении температуры скорость химической адсорбции и ее величина, пройдя через минимум, начинают возрастать. Это возрастание вызвано тем, что при измерении не достигается равновесия. Однако при повышении температуры убывание равновесной величины адсорбции вызовет падение адсорбции и появление максимума Г. При дальнейшем повышении температуры может начаться химический процесс с большей энергией активации, что вызывает появление нового максимума Г. Наличие такого рода максимумов свидетельствует об участии в адсорбции активированных процессов. Такие максимумы имеются, например, для случаев адсорбции кислорода на угле и металлах, азота - на железе. Активированная адсорбция имеет особое значение для гетерогенного катализа.
Химическая адсорбция не всегда бывает активированной и ее скорость может быть достаточно велика при низких температурах. Так, адсорбция непредельных органических соединений, например этилена, на алюмогеле и силикагеле либо адсорбция окиси углерода на дегидратированных алюмосиликатах (так называемые молекулярные сита) являются примерами химической неактивированной адсорбции, протекающей достаточно быстро при низких температурах.
Процесс адсорбции развивается последовательно, по мере убывания энергетического уровня поверхности. Адсорбция начинается прежде всего на тех участках поверхности, энергия которых максимальна. Такими участками являются вершины, углы, ребра или в широком смысле - активные центры. Только когда эти предпочтительные в энергетическом отношении места адсорбции будут насыщены, начнется адсорбция на плоских участках поверхности, на которых при адсорбции высвобождается меньшее количество энергии. Здесь происходит взаимодействие между адсорбированными атомами или молекулами.
Незначительная величина энтальпии при физической адсорбции (около 10 ккал/моль) указывает на низкую энергию взаимодействия между адсорбированными атомами и поверхностью кристалла. Поэтому физическая адсорбция не является специфической для поверхности кристаллов, т.е. количества газа, адсорбированные на различных гранях кристалла, сравнимы между собой.
Если трущиеся поверхности разделены адсорбционными слоями, то не будет происходить металлического контактирования металлов, что обусловит низкий коэффициент трения и малый износ. Наличие оксидных и различных адсорбционных пленок резко снижает прочность образовавшихся «мостиков» схватывания.
Адсорбция влияет на структуру тонкого поверхностного слоя и ряд свойств, таких, как модуль упругости, параметр кристаллической решетки и его прочность. Эта совокупность явлений иногда называют эффектом силового поля.
Лекция 3. Основы теории физической адсорбции и хемосорбции.
Дата добавления: 2016-10-26; просмотров: 5042;











