Тепловой эффект химической реакции зависит от состояния исходных веществ и продуктов реакции, но не зависит от промежуточных стадий реакций.
Пример: Тепловой эффект реакции окисления углерода в оксид углерода (IV) не зависит от того, проводится ли это окисление непосредственно:
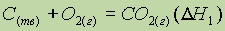
или через промежуточную стадию образования оксида углерода (II):

Из закона Гесса следует, что если известны общий тепловой эффект реакции и тепловой эффект одной из двух ее промежуточных стадий, то можно вычислить тепловой эффект(х) второй промежуточной стадии, т. е. если 
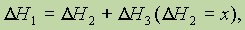 то
то 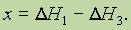
Это положение очень важно, так как позволяет рассчитывать тепловые эффекты для реакций, не поддающихся непосредственному экспериментальному изучению.
Если теплота образования какого-либо вещества из простых веществ не измерена экспериментально, то для расчета можно воспользоваться значениями D Н ряда других соединений; комбинируя эти значения, можно получить D Нобр искомого соединения.
Особенно удобно проводить такие расчеты, используя следствия, непосредственно вытекающие из закона Гесса:
Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ(суммирование проводится с учетом числа молей веществ, участвующих в реакции, т. е. стехиометрических коэффициентов в уравнении протекающей реакции):
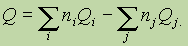
Здесь Qi, Qj — теплоты образования продуктов реакции и исходных веществ соответственно; ni, и nj — стехиометрические коэффициенты в правой и левой частях термохимического уравнения соответственно.
Аналогичным образом можно записать:
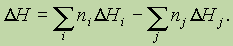
где D н — изменение энтальпии соответствующей реакции,D Hi, D Hj— энтальпии образования продуктов реакции и исходных веществ соответственно.
Химическая кинетикатрактует качественные и количественные изменения в ходе химического процесса, происходящие во времени. Обычно эту общую задачу подразделяют на две более конкретные:
1) выявление механизма реакции — установление элементарных стадий процесса и последовательности их протекания (качественные изменения);
2) количественное описание химической реакции — установление строгих соотношений, которые могли бы удовлетворительно предсказывать изменения количеств исходных реагентов и продуктов по мере протекания реакции.
Как правило, химическая реакция протекает в несколько промежуточных стадий, которые, складываясь, дают суммарную реакцию.
Элементарная стадия реакции.Кинетическое уравнение химической реакции (с учетом механизма реакции) может быть получено только в результате экспериментального изучения реакции и не может быть выведено из стехиометрического уравнения суммарной реакции. При обсуждении механизмов реакций принято различать реакции по их молекулярности, т. е. по числу молекул, участвующих в каждом элементарном акте взаимодействия. По этому признаку различают реакции мономолекулярные, бимолекулярные и тримолекулярные.
Мономолекулярныминазываются реакции, в которых элементарный акт представляет собой химическое превращение одной молекулы, которое в общем виде можно описать уравнением
А = В + С.
Бимолекулярные — это такие реакции, элементарный акт в которых осуществляется при столкновении двух молекул
А + В = С.
В тримолекулярныхреакциях элементарный акт осуществляется при одновременном столкновении трех молекул
2А + В = С.
Столкновение более чем трех молекул одновременно практически невероятно, поэтому реакции большей молекулярности на практике не обнаружены.
Дата добавления: 2016-10-26; просмотров: 2747;











