Энтальпия Н — это определенное свойство вещества, оно является мерой энергии, накапливаемой веществом при его образовании.
Процессы, протекающие при постоянном давлении, встречаются гораздо чаще, чем те, которые протекают при постоянном объеме, так как большинство из них проводится в открытых сосудах. Доказано, что в химических процессах, протекающих при постоянном давлении, выделившееся (или поглощенное) тепло есть мера уменьшения (или соответственно увеличения) энтальпии реакции D H.
При экзотермических реакциях, когда тепло выделяется, D Н отрицательно. При эндотермическихреакциях(тепло поглощается) и D H положительно.
Термохимические уравнения.На первых этапах изучения химии вы часто пользовались равным по абсолютной величине и противоположным по знаку обозначением, например:
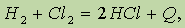
где Q — количество выделенной теплоты. Если использовать энтальпию (характеристику энергосодержания системы), то это уравнение следует записать иначе:
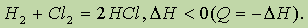

В справочных таблицах обычно приводят не значения величины Q, а значения величины D H, измеренные при определенных условиях (чаще всего при 298 К);их обозначают D H0.
Теплота образования химических соединений. Теплотой образования соединения называется количество теплоты, которое выделяется или поглощается при образовании одного моля химического соединения из простых веществ при стандартныхусловиях(р = 105 Па, T = 298 К). Она измеряется в кДж/моль. Согласно этому определению, теплота образования простого вещества при стандартных условиях равна О.
Изменение энтальпии D Н зависит от давления и температуры. Поэтому для того, чтобы облегчить сравнение термохимических данных для различных реакций, были приняты определенные стандартные состояния (условия).
При написании термохимических уравнений твердое вещество, жидкость и газ обязательно обозначаются символами (тв), (ж) и (г) соответственно, поскольку изменение энтальпии зависит от агрегатного состояния реагирующих веществ и продуктов реакции. Стандартное состояние: для газа — состояние чистого газа при 105 Па; для жидкости — состояние чистой жидкости при 105 Па; для твердого вещества — наиболее устойчивое при давлении 105 Па кристаллическое состояние, например графит у углерода, ромбическая сера у серы и т. п. Стандартное состояние всегда относится к 298 К. Так, например, термохимическое уравнение образования воды из водорода и кислорода записывается следующим образом:
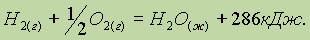
Значение 286 кДж является теплотой образования воды в стандартных условиях и означает, что при образовании 1 моля воды выделяется 286 кДж теплоты:
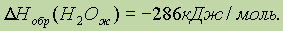
Отметим, что значение теплоты образования газообразной воды уже будет иным:
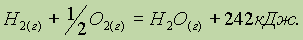
Закон Гесса и его следствия.Важнейшим законом, на котором основано большинство термохимических расчетов, является закон Гесса (его называют также законом суммы тепловых эффектов).
Дата добавления: 2016-10-26; просмотров: 3567;











