Скорость химической реакции при постоянной температуре прямо пропорциональна произведению концентраций реагирующих веществ.
Для мономолекулярной реакции скорость реакции u определяется концентрацией молекул вещества А:
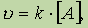
где k — коэффициент пропорциональности, который называется константой скорости реакции;[А] — молярная концентрация вещества А.
В случае бимолекулярной реакции, ее скорость определяется концентрацией молекул не только вещества А, но и вещества В:
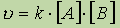
В случае тримолекулярной реакции, скорость реакции выражается уравнением:
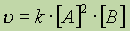
В общем случае, если в реакцию вступают одновременно т молекул вещества А и n молекул вещества В, т. е.
тА + пВ = С,
уравнение скорости реакции имеет вид:
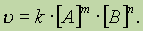
Это уравнение есть математическое выражение закона действующих масс в общем виде.
Чтобы понять физический смысл константы скорости реакции, надо принять в написанных выше уравнениях, что [А] = 1 моль/л и [В] = 1 моль/л (либо приравнять единице их произведение), и тогда u = k. Отсюда ясно, что константа скорости k численно равна скорости реакции, когда концентрации реагирующих веществ (или их произведение в уравнениях скорости) равны единице.
Общее выражениедля скорости химической реакцииполучено для данной, фиксированной температуры. В общем же случае, поскольку скорость реакции зависит от температуры, закон действующих масс записывается как
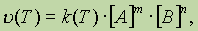
где u и k являются функциями температуры.
Дата добавления: 2016-10-26; просмотров: 2659;











