Ковалентные s- и p-связи
s- и p-Связи различают по симметрии перекрывания орбиталей.
Если линия, соединяющая ядра связанных атомов, проходит через область перекрывания орбиталей, связь называется s-связью; если об- ласть перекрывания лежит в стороне от этой линии – p-связью.
s-Связи образуются при перекрывании s-s орбиталей атомов (А),
р-p орбиталей (В), s-p орбиталей (С) и гибридных орбиталей (рис. 2.2).
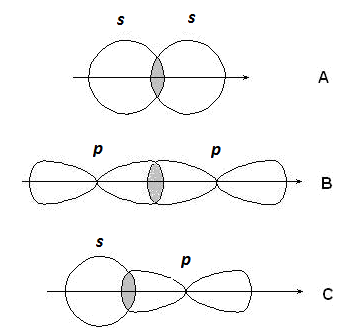
Рис. 2.2. Образование s-связей
p-Связи образуются при боковом перекрывании р-р орбиталей, оси которых параллельны друг другу (рис. 2.3).
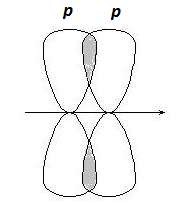
Рис. 2.3. Образование p-связей
В результате такого перекрывания образуются две области повы- шенной электронной плотности. Ни одна из этих областей не лежит на линии, соединяющей центры ядер двух атомов.
p-Связь менее прочная, чем s-связь, ее электроны легче подверже- ны внешнему воздействию. В соединениях с кратными связями только одна из связей является s-cвязью, образованная перекрыванием s-, р- или гибридных орбиталей, а остальные – p-связями, образованными пе- рекрыванием негибридизованных р-орбиталей атомов, например, двой- ная связь, образованная гибридными орбиталями (s-связь) и не участ- вующими в гибридизации р-орбиталями (p-связь).
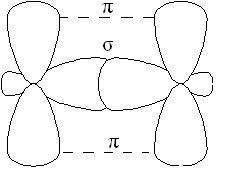
Рис. 2.4. Образование двойной связи
В молекулах алкенов, в частности этилена, орбитали атомов угле- рода при двойной связи находятся в состоянии sp2-гибридизации, все С–Н и С–С связи лежат в одной плоскости, перекрывание негибридных р-орбиталей атомов углерода происходит в плоскости, перпендикуляр- ной плоскости s-связей (рис. 2.4). Иногда эту плоскость называют плос- костью p-связи.
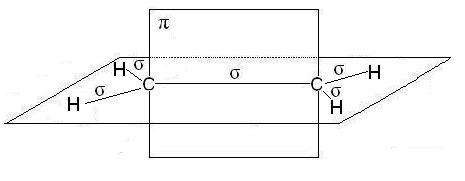
Рис. 2.4. Расположение s- и p-связей в молекуле этилена
В случае тройной связи, например в молекулах алкинов, орбитали атомов углерода при тройной связи имеют sp-гибридизацию. Две
p-связи, образованные перекрыванием негибридных р-орбиталей ато- мов углерода (по две от каждого из атомов), лежат в двух взаимно пер- пендикулярных плоскостях (рис. 2.5).
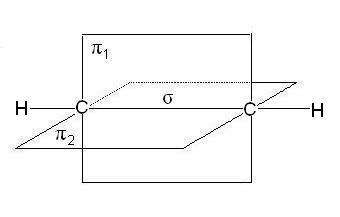
Рис. 2.5. Расположение s- и двух p-связей в молекуле ацетилена
В табл. 2.1 приведены основные характеристики связей между ато- мами углерода.
Таблица 2.1 Основные характеристики связей между атомами углерода
| Связь | Тип гибридизации | Длина (нм) | Энергия (кДж/моль) |
| C–C | sp3 | 0,154 | |
| C=C | sp2 | 0,134 | |
| C≡C | sp | 0,120 |
Дата добавления: 2021-01-26; просмотров: 654;











