ХИМИЧЕСКИЕ СВЯЗИ В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ
Типы химических связей
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов и т.д. По своей природе химическая связь – это электростатические силы. Главную роль при образовании химической связи между атомами игра- ют их валентные электроны, т.е. электроны внешнего уровня, наименее прочно связанные с ядром. При переходе от атомного состояния к моле- кулярному происходит выделение энергии, связанное с заполнением электронами свободных орбиталей внешнего электронного уровня до определенного устойчивого состояния. Существуют следующие виды химических связей:
Ионная связь
Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью.
Такая связь возникает при большой разнице в электроотрицатель- ностях связываемых атомов, когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом.
Например: хлорид натрия NaCl
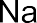
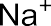
Атом натрия имеет 1 электрон на внешнем уровне, а атом хлора – 7 внешних электронов. Они превращаются в ионы Na+ и Cl– с завершен- ными внешними электронными оболочками (по 8 электронов), между которыми возникает электростатическое притяжение, т.е. ионная связь.
Иoннaя связь не имеет пространственной направленности, т.к. каж- дый ион связан с некоторым числом противоионов, сила действия кото- рых зависит от расстояния (закон Кулона). Поэтому соединения с ион- ной связью не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки с вы- сокими температурами плавления и кипения; они высокополярны, часто
солеобразны, в водных растворах электропроводны. Соединений с чис- то ионными связями практически не существует.
В органических соединениях ионные связи встречаются доволь- но редко, т.к. атом углерода не склонен терять или приобретать электроны с образованием ионов.
Ковалентная связь
Ковалентная связь – это химическая связь, осуществляемая за счет обобществленияэлектронных пар. Теорию ковалентной связи предложил в 1916 г. американский ученый Гилберт Льюис. За счет ко- валентной связи образуется большинство молекул, молекулярных ио- нов, свободных радикалов и атомных кристаллических решеток. Обяза- тельным условием образования ковалентной связи является перекрыва- ние атомных орбиталей (АО), на которых расположены валентные элек- троны. В простейшем случае перекрывание двух АО приводит к образо- ванию двух молекулярных орбиталей (МО): связывающей МО и анти- связывающей (разрыхляющей) МО. Обобществленные электроны рас- полагаются на более низкой по энергии связывающей МО (рис. 2.1).
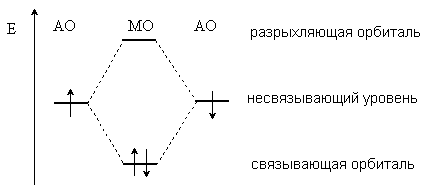
Рис. 2.1. Образование двух МО при перекрывании двух АО
Характерные свойства ковалентной связи – направленность, насы- щаемость, полярность, поляризуемость – определяют химические и фи- зические свойства органических соединений.
Направленность связи обусловливает молекулярное строение ор- ганических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ог- раничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на непо- лярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реа- гирующей частицы. Поляризуемость определяется подвижностью элек- тронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет ре- акционную способность молекул по отношению к полярным реагентам.
Дата добавления: 2021-01-26; просмотров: 715;











