Классификация по типу разрыва связей и типу реагента
Элементарные реакции, в зависимости от типа разрыва связей, де- лят на три основных типа:
· Гетеролитические реакции– реакции, в которых разрыв связи происходит несимметрично, так что пара электронов связи остается у одного из образующихся фрагментов.



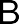
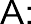
В ходе таких реакций часто образуются ионные интермедиаты (промежуточные частицы) – карбокатионы и карбанионы. Например:
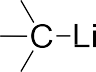
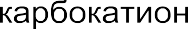
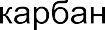

Карбокатионы представляют собой положительно заряженные час- тицы с тремя заместителями при центральном атоме углерода, имею- щем одну вакантную несвязывающую орбиталь.
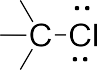
Карбанионы – отрицательно заряженные частицы с тремя замести- телями при центральном атоме углерода, имеющем несвязывающую ор- биталь с парой электронов.
· Гомолитические реакции– реакции, в которых разрыв связи происходит симметрично, так что каждому из образующихся фрагмен- тов отходит по одному электрону:
A : B A + B
В ходе гомолитических реакций в качестве интермедиатов образу- ются свободные радикалы – частицы, содержащие неспаренный элек- трон, например:

· Синхронные реакции– это особый тип реакций, в которых разрыв старых и образование новых связей происходят одновременно за счет согласованного перемещения электронов в циклическом комплек- се. Это реакции, в которых две или несколько ненасыщенных молекул соединяются с образованием одного циклического продукта и происхо- дит общее уменьшение кратности связей. Примером таких реакций мо- жет служить реакция Дильса – Альдера:
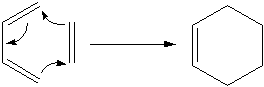
Взаимодействующие в органической реакции вещества подразде- ляют на реагенти субстрат. При этом считается, что реагент атакует субстрат. Субстратом, как правило, считают молекулу, которая предос- тавляет атом углерода для новой связи. Например, в реакции (1) алкен является субстратом, а молекула брома – реагентом. По типу реагента реакции делятся на электрофильные (Е), нуклеофильные (N) и ради- кальные (R).
В нуклеофильных реакциях реагент (нуклеофил) имеет на одном из атомов свободную пару электронов и является нейтральной молекулой (H2O, ROH, NH3, RNH2) или анионом (Hal–, OH–, RO–, RS–, RCOO–, R–,
CN– и др.). Все нуклеофилы – основания Льюиса. Нуклеофил атакует в субстрате атом с наименьшей электронной плотностью (т.е. с частич- ным или полным положительным зарядом). При этом новая связь обра-
зуется за счет электронной пары нуклеофила, а старая претерпевает ге- теролитический разрыв. Примером нуклеофильной реакции может служить нуклеофильное замещение (символ SN) у насыщенного атома углерода:




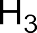

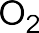






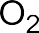

В электрофильных реакциях атакующий реагент (электрофил) имеет вакантную орбиталь и является нейтральной молекулой с полярными или легко поляризуемыми связями (SO3, BF3 Cl2) или катионом (H+, Br+, СН3+, NO2+ и др.). Все электрофилы – кислоты Льюиса. Электрофил атакует в субстрате атом с наибольшей электронной плотностью, причем старая связь претерпевает гетеролитический распад, а образование но- вой связи происходит за счет пары электронов субстрата. Пример электрофильной реакции – электрофильное присоединение (символ AdE) к С=С связи:





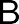
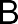

В радикальных реакциях реагент имеет неспаренный электрон и является свободным радикалом (Cl˙ ,˙С2Н5 и др.). В ходе радикальных реакций связь в субстрате разрывается гомолитически, а новая связь образуется за счет неспаренного электрона свободного радикала и одного из электронов старой связи. Примером радикальных реакций может служить радикальное замещение (символ SR) в алканах:
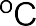 >
>
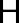

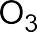
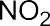 В зависимости от числа частиц, участвующих в элементарных реакциях, различают мономолекулярные и бимолекулярные реакции. Часто разные способы классификации используют в сочетании друг с другом. Например, далее будут рассмотрены реакции мономолекулярного и бимолекулярного нуклеофильного замещения (символы SN1 и SN2), мономолекулярного и бимолекулярного элиминирования (символы Е1 и Е2) и др.
В зависимости от числа частиц, участвующих в элементарных реакциях, различают мономолекулярные и бимолекулярные реакции. Часто разные способы классификации используют в сочетании друг с другом. Например, далее будут рассмотрены реакции мономолекулярного и бимолекулярного нуклеофильного замещения (символы SN1 и SN2), мономолекулярного и бимолекулярного элиминирования (символы Е1 и Е2) и др.
Лишь незначительное число органических реакций являются эле- ментарными. Большинство из них являются сложными и состоят из нескольких последовательных или параллельных элементарных стадий.
Дата добавления: 2021-01-26; просмотров: 534;











