Спирт — растворитель.
а).Приготовление лака. Наливают в пробирку 1/4 ее объема спирта и растворяют в нем 2—3 г какой-либо смолы. Для быстрого растворения пробирку можно подогреть в стаканчике с горячей водой. Получившийся лак можно подкрасить какой-нибудь краской. С помощью ватки слой лака наносят на гладкую поверхность дерева.
б). Приготовление йодной тинкстуры. В две пробирки помещают равные количества измельченного иода; в одну пробирку приливают воду, а в другую столько же спирта.
Наблюдается быстрое растворение иода в спирте и плохая растворимость его в воде. Полученный спиртовой раствор иода может быть использован в школьной аптечке.
В пробирку с иодом и водой бросают несколько кристалликов иодида калия и смесь встряхивают. Наблюдается растворение иода.
Горение спирта. Спирт воспламеняется не только при поджигании, но и при действии ряда энергичных окислителей. Горение спирта выражается уравнением:
С2Н5ОН + ЗО2 à 2СО2 + ЗН2O
Приводимые ниже опыты свидетельствуют одновременно о сравнительно легкой окисляемости спирта.
а) Спирт, налитый в фарфоровую чашку, поджигают лучинкой; он горит бледно-голубым пламенем. Тушат пламя, покрывая чашку стеклом.
б) На металлическую пластинку помещают кристаллы оксида хрома (VI) СгО3 и с небольшой высоты опускают на них из пипетки несколько капель спирта. Спирт вспыхивает. При этом оксид хрома(VI) превращается в зеленый оксид хрома (III).
в) На фарфоровой пластинке к небольшому количеству измельченного перманганата калия добавляют концентрированной серной кислоты столько, чтобы получилась густая кашица. На образовавшийся оксид марганца (VII) капают несколько капель спирта. Спирт вспыхивает.
Обнаружение спирта в вине или пиве. В круглодонную колбу наливают 50—100 мл пива или вина, колбу закрывают пробкой с вертикальной стеклянной трубкой. Нагревают колбу до кипения и
через некоторое время поджигают пары спирта у верхнего конца трубки. Пиво предварительно должно быть хорошо взболтано для удаления углекислого газа, иначе при нагревании будет происходить сильное вспенивание.
Взаимодействие спирта с натрием. Реакция спирта с натрием — это первый опыт, показывающий резкое отличие химических свойств спирта от свойств предельных углеводородов. Назначение опыта: ознакомить учащихся с характерной для спиртов реакцией и продуктами, получающимися при этом.
В маленькую пробирку с 1—2 мл абсолютного спирта бросают 2-3 маленьких кусочка натрия. Наблюдают выделение газа. Пробирку закрывают пробкой с маленькой стеклянной трубочкой, конец которой оттянут. Выждав некоторое время, пока будет вытеснен из пробирки воздух, поджигают выделяющийся газ — водород.
После того как весь натрий прореагирует, пробирку охлаждают в стакане с водой. При охлаждении выпадает осадок алкоголята натрия. Если алкоголят не выделяется, раствор выливают в фарфоровую чашечку и осторожно выпаривают над пламенем спиртовки непрореагировавший спирт. Если, наоборот, натрий прореагировал не полностью, избыток его удаляют или заставляют прореагировать, добавляя немного спирта.
К алкоголяту натрия добавляют немного воды и 1—2 капли раствора фенолфталеина. Индикатор показывает щелочную реакцию. Обращают внимание учащихся на то, что для правильных выводов спирт должен быть безводным и что натрий должен прореагировать со спиртом полностью.
Если опыт ставится в большем масштабе, то выделение водорода дополнительно доказывается появлением паров воды при горении его под сухим стаканом.
Дегидратация этанола. Структурная формула этанола может быть подтверждена при изучении его дегидратации, идущей с образованием этилена.
В качестве катализатора для реакции лучше взять оксид алюминия, так как серная кислота, поглощая воду, не даст возможности ее обнаружить.
Собирают прибор, как показано на рис. 21. В фарфоровую или железную трубку насыпают оксид алюминия АI2О3, в делительную воронку наливают абсолютный спирт, в маленькую колбочку с отводной трубкой помещают обезвоженный сульфат меди. Нагревания до необходимой температуры можно достичь с помощью нескольких горелок.
Когда трубка с катализатором будет нагрета, пускают спирт по
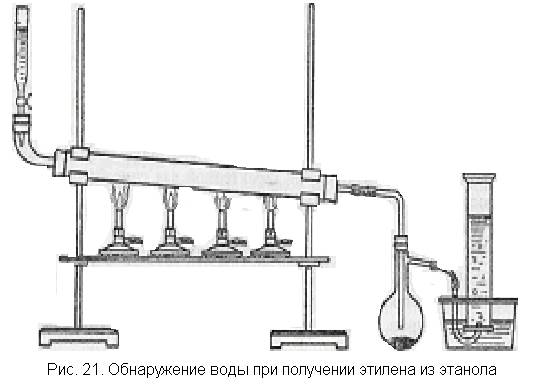
1 капле в секунду. Образующаяся вода не может остаться в нагретой трубке и в виде паров поступает в колбу, где конденсируется и образует с сульфатом меди синие кристаллики медного купороса. В цилиндре после вытеснения из прибора воздуха собирают этилен и затем проводят с ним одну из характерных реакций.
Для подтверждения структурной формулы спирта важно установить, что образование молекулы воды происходит за счет одной, а не двух молекул спирта. Можно было бы предположить, что вода отщепляется по схеме:
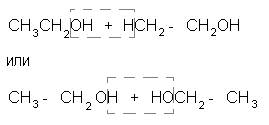
и образуются вещества без двойных связей в молекулах. Однако изучение собранного газа не оставляет сомнений, что он представляет собой непредельное соединение, т.е. что молекула воды отщепилась от одной молекулы спирта:
СН3 - СН2ОН à СН2 = СН2 + Н2О
Взаимодействие спирта с бромоводородом. Бромистоводородной кислотой школьные лаборатории обычно не располагают, поэтому в данном опыте получают бромоводород непосредственно в том сосуде, где должна пройти его реакция со спиртом. Исходными веществами являются: спирт, бромид калия и концентрированная серная кислота.
Учителю, однако, следует иметь в виду, что всякий раз, когда в
смеси содержатся спирт и серная кислота, прежде всего идет реакция между ними с образованием этилсерной кислоты:
С2Н5ОН + НО - SO2OH à Н2О + С2Н5 - О - SO2OH
которая и вступает в дальнейшие реакции. В данном случае она реагирует с бромидом калия:
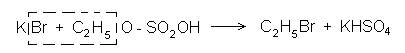
Собирают типовой прибор для перегонки жидкостей и в колбу помещают смесь, состоящую из 10 мл концентрированной серной кислоты и 10 мл этанола, происходит образование этилсерной кислоты. Охладив колбу, добавляют 10 мл воды и 5-7 г бромида калия. Колбу закрывают пробкой и нагревают на сильном пламени через асбестовую сетку. Для большего выхода продукта необходимо применение водяного холодильника (температура кипения С2Н5Вг 38,4°С). С этой же целью в приемник наливают холодную воду и даже помещают несколько кусочков льда и ставят приемник в сосуд с водой и льдом.
Капли тяжелого бромэтана при перегонке падают на дно. Внизу образуется слой маслянистой жидкости. Опыт прекращают, когда отогнано необходимое количество вещества, для чего вначале убирают приемник, а затем тушат горелку. Бромэтан может быть показан классу под водой. Параллельно демонстрируется чистый образец. Извлечение и очистка продукта производятся на внеклассных занятиях; полученный бромэтан демонстрируют при опросе на следующем уроке.
Для извлечения чистого вещества бромэтан отделяют с помощью делительной воронки, затем добавляют к нему двойное количество воды, взбалтывают, чтобы в ней растворились перегнавшиеся спирт, кислоты и различные продукты разложения, снова отделяют водный слой и сушат от остатков воды несколькими кусочками хлорида кальция. После этого бромэтан становится совершенно прозрачным и бесцветным.
В химическом кружке чистый бромэтан может быть получен в значительно большем количестве для демонстрационной коллекции и целого ряда опытов с ним (например, для синтеза углеводородов).
Получение иодэтана. Иодэтан легко образуется при непосредственном воздействии иодоводорода на спирт. Для этого не требуется даже присутствия водоотнимающего средства. Достаточно прокипятить в колбе с обратным холодильником смесь спирта с концентрированной иодистоводородной кислотой в отношении примерно 1: 3 и затем разбавить водой, чтобы внизу выделился слой иодэтана.
Можно получить иодэтан и насыщением спирта газообразным иодоводородом .
Отсутствие иодистоводородной кислоты в школе прежде всего наводит на мысль получать иодэтан методом, аналогичным получению бромэтана. Однако, как известно, при взаимодействии иодида калия или натрия с концентрированной серной кислотой образующийся иодоводород легко окисляется, что делает этот способ практически неприемлемым.
Иодэтан чаще всего получают взаимодействием спирта с иодидом фосфора (III). В качестве исходных веществ для реакции берут спирт, иод и фосфор. Два последних вещества реагируют, образуя Р13, который сразу же взаимодействует со спиртом.
З С2Н5ОН + PI3 à 3 С2Н5I + Н3РO3
В круглодонную колбу наливают 15 мл этанола и помещают 2 г красного фосфора, высушенного в эксикаторе над концентрированной серной кислотой. Затем частями добавляют 18—20 г йода, закрывая после каждого прибавления колбу пробкой с вертикальной трубкой-холодильником и тщательно взбалтывая. Иод вносят частями для того, чтобы реакция не шла слишком бурно. Если смесь сильно разогревается, колбу охлаждают в холодной воде. Чтобы смесь имела жидкую консистенцию и хорошо перемешивалась при встряхивании, берется избыток спирта по отношению к теоретическому.
После того как весь иод внесен, колбу закрывают пробкой с вертикальной трубкой и нагревают в течение 20-30 мин на водяной бане. Затем, присоединив вместо трубки обычный нисходящий холодильник, отгоняют иодэтан.
Собирающийся в приемнике иодэтан оказывается окрашенным йодом, частично улетучивающимся при перегонке, и содержит примесь спирта. Очищают дистиллят от примеси йода, добавляя по каплям раствор едкого натра до исчезновения бурой окраски. Гидроксид натрия реагирует с йодом:
2 NaOH + I2 à Nal + NalO + Н2О
Водный слой удаляют с помощью делительной воронки. Для окончательного удаления продуктов реакции йода со щелочью и спиртом иодэтан промывают еще раз водой и наконец сушат гранулированным хлоридом кальция.
Собранный продукт может быть взвешен и таким образом определен выход вещества.
Качественная реакция на спирт. Чувствительной реакцией на этиловый спирт (хотя и недостаточно специфичной) является так называемая иодоформная проба: образование характерного желтого осадка йодоформа при действии на спирт йода и щелочи. При этом последовательно протекают следующие реакции:

или суммарно:
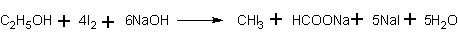
Таким способом удается установить наличие спирта в воде даже при концентрации 0,05%.
Знание иодоформной реакции (хотя бы по внешним проявлениям, без химизма процесса) помогает при изучении спирта и дает возможность поставить целый ряд интересных опытов с ним (например, получение спирта гидратацией этилена по А.М.Бутлерову).
1. В пробирку с исследуемой жидкостью бросают очень немного (1-2 кристаллика) истолченного йода или приливают 1—2 мл раствора его в иодиде калия. Смесь нагревают и приливают понемногу раствор едкого натра до обесцвечивания избытка йода. При охлаждении выпадают кристаллы йодоформа.
При малой концентрации спирта ясно ощущается лишь запах йодоформа, а кристаллы образуются после более или менее длительного стояния (например, на следующий день).
2. Когда подобный опыт нужно поставить не с целью качественного определения спирта, а для получения значительных количеств йодоформа, то его видоизменяют следующим образом. В колбу наливают 20 мл спирта, 80 мл воды, добавляют 15 г поташа и столько же растертого йода. Смесь взбалтывают и нагревают на водяной бане до исчезновения окраски йода. После того как начнут выпадать кристаллы, колбу оставляют стоять до охлаждения, после чего отделяют кристаллы и промывают их декантацией, стараясь быстрее закончить работу вследствие неприятного запаха йодоформа.
Получение этилового спирта из бромэтана. Демонстрация этого опыта показывает генетическую связь между различными классами органических соединений, именно переход от предельных уг-лсиодородов через галогенопроизводные к спиртам. К сожалению, опыт, который давал бы возможность непосредственно обнаружить появление спирта, требует много времени и поэтому, начатый на уроке, он может быть закончен лишь на следующем занятии. Опыт может быть также поставлен в кружке; в таком случае доступно будет выделение полученного продукта.
В небольшую колбу помешают 4—5 мл бромэтана и 20 мл водного раствора гидроксида калия. Колбу закрывают пробкой с обратным водяным холодильником и смесь кипятят на масляной бане в течение нескольких часов, пока жидкость не станет совершенно однородной. Это будет означать, что бромэтан (нерастворимый в воде) полностью прореагировал.
Из реакционной смеси отгоняют часть жидкости и производят иодоформную реакцию.
Получение этилового спита брожением сахара. В данной теме учащиеся знакомятся с брожением, как способом получения этанола. В дальнейшем, при изучении углеводов, они узнают, что брожение — это лишь одно из звеньев в процессе получения спирта из полисахаридов — крахмала и клетчатки.
 В плоскодонную колбу (рис. 22) наливают раствор 20 г обычного сахара или глюкозы в 100 г воды. Туда же вносят 3-4 г растертых с водой дрожжей (хорошо взять пивные дрожжи). Колбу закрывают пробкой с отводной трубкой, соединенной в свою очередь с U-образной трубкой, содержащей прозрачную (свежепрофильтрованную) известковую или баритовую воду. Ко второму колену U-образной трубки присоединяют хлоркальциевую трубку с натронной известью.
В плоскодонную колбу (рис. 22) наливают раствор 20 г обычного сахара или глюкозы в 100 г воды. Туда же вносят 3-4 г растертых с водой дрожжей (хорошо взять пивные дрожжи). Колбу закрывают пробкой с отводной трубкой, соединенной в свою очередь с U-образной трубкой, содержащей прозрачную (свежепрофильтрованную) известковую или баритовую воду. Ко второму колену U-образной трубки присоединяют хлоркальциевую трубку с натронной известью.
Колбу подогревают на водяной бане до 30—35аС. Начинается процесс брожения, о котором судят по выделению пузырьков газа и помутнению раствора в U-образной трубке.
На уроке может быть констатировано лишь образование углекислого газа при брожении. Чтобы в растворе образовалось заметное количество спирта, прибор
оставляют до следующего занятия в теплом месте (например, вблизи батареи отопления или печки), учащиеся ведут за ним наблюдение. Перегрев отрицательно сказывается на процессе брожения, поэтому не следует допускать повышения температуры выше указанной.
На следующем уроке к колбе присоединяют холодильник и отгоняют небольшое количество жидкости. В дистилляте доказывают наличие спирта иодоформной реакцией.
U-образную трубку промывают раствором соляной кислоты от осадка карбоната.
Получение этанола из этилена в присутствии серной кислоты. Получение этилового спирта из этилена было подробно изучено A.M. Бутлеровым. Он получал этанод гидратацией этилена в присутствии того же катализатора — концентрированной серной кислоты, который применяется и для обратной реакции — получения этилена из спирта. А.М.Бутлеров показал, что эта реакция является общей для получения спиртов из непредельных углеводородов, и предсказал ее промышленное значение.
Сейчас реакция гидратации непредельных углеводородов широко используется в промышленности для получения различных
спиртов.
В связи с необходимостью замены пищевого сырья и утилизации газов крекинга нефти этанол в больших количествах получают из этилена.
Демонстрация этого способа в классе важна, таким образом, с трех точек зрения: учащиеся знакомятся с одной из важных экспериментальных работ нашего гениального соотечественника, получают частичное представление о путях развития современной промышленности органической химии и знакомятся с влиянием условий на направление реакции в ту или иную сторону.
Можно считать демонстрацию этого способа получения спирта в данной части курса более целесообразной, чем демонстрацию получения спирта брожением крахмала. В химизме процессов гидролиза и брожения, даже в элементарной форме, разобраться учащимся до изучения углеводов чрезвычайно трудно, химизм же гидратации этилена довольно прост. Кроме того, предлагаемый опыт способствует установлению связи с ранее изученным материалом и закреплению знаний о химических свойствах непредельных углеводородов.
Единственная методическая трудность при постановке опыта состоит в том, что при кратковременности демонстрации не удается получить значительного количества этилового спирта и доказывать образование его приходится только иодоформной реакцией.
В промышленности этиловый спирт получают из этилена без применения серной кислоты путем прямой гидратации этилена водяным паром в присутствии ортофосфорной кислоты как катализатора.
Опыт сернокислотной гидратации, в соответствии с промышленным его осуществлением, состоит из двух частей. Сначала растворяют этилен в концентрированной серной кислоте, при этом образуется моноэтиловый эфир серной кислоты.
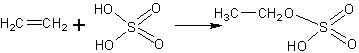
Затем растров разбавляют водой, при этом образуется этанол и освобождается серная кислота:
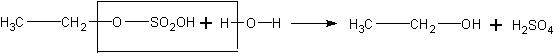
Понятно, что при изучении этого процесса в классе дается лишь суммарное уравнение реакции:
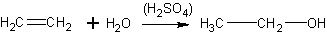
Серная кислота рассматривается как растворитель этилена и катализатор реакции (без указания механизма каталитического действия).
Лабораторная установка для проведения опыта чрезвычайно проста (рис. 23). Основную часть ее составляет прибор для получения этилена. Этилен следует пропустить через промывные склянки, чтобы спирт из колбы не попал в серную кислоту, где будет получаться спирт из этилена.
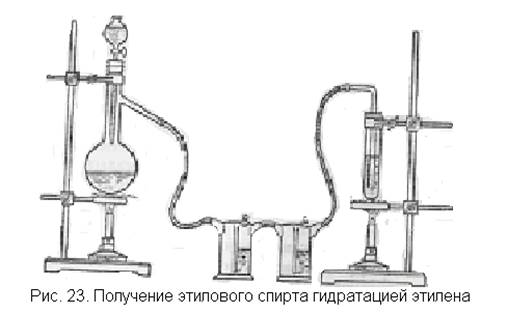
В колбу наливают смесь этанола с концентрированной серной кислотой и насыпают немного фарфоровой крошки (см. получение этилена, с. 46). Капельную воронку заполняют такой же смесью на случай, если выделение этилена в колбе быстро прекратится. К колбе присоединяют одну или две промывалки с серной кислотой для удержания паров спирта и пробирку или небольшую колбочку с концентрированной серной кислотой для поглощения этилена.
В промышленности этилен пропускают в серную кислоту под давлением в 10 ат и при нагревании до 70°С. В школьных условиях, преследуя чисто качественные, а не количественные цели опыт удается провести без применения давления.
Когда прибор собран и проверен, начинают нагревать колбу со спиртом и серной кислотой, чтобы установился равномерный ток газа. Одновременно нагревают пробирку с кислотой для поглощения этилена (примерно до 70—80"С). Во время опыта надо следить, чтобы кислоту из пробирки не перебросило в промывалку. Поэтому, если будет замечено падение давления этилена, сразу же вынимают трубку из пробирки, после чего добавляют в колбу смесь из воронки и затем снова опускают трубку. Примерно через 10 мин пропускания газа опыт прекращают. При этом сперва вынимают трубку из пробирки и только после этого прекращают нагревание.
Полученный раствор этилена в кислоте выливают понемногу в перегонную колбу, содержащую около 100 мл воды, все время охлаждая колбу в токе холодной воды, чтобы избежать потери спирта. Когда весь раствор прилит, насыпают в колбу немного фарфоровой крошки, закрывают колбу пробкой, присоединяют холодильник и в приемник отгоняют несколько миллилитров жидкости, содержащей спирт, который обнаруживают иодоформной реакций (с. 81). Раствор кислоты годен для использования при других опытах.
Опыт удается только с очень концентрированной серной кислотой или олеумом.
МЕТАНОЛ
Ряд опытов с метанолом может быть поставлен по аналогии с вышеописанным, при этом нет необходимости воспроизводить опыты в том объеме, как они ставятся при изучении этанола.
Поэтому здесь описываются опыты, характеризующие лишь некоторые особенности самого метанола.
Взаимодействие метанола с хлороводородом. Очень ле1 ко и быстро можно получить хлорметан по реакции:
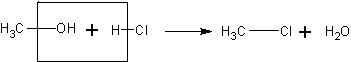
Демонстрация этого опыта подтверждает наличие гидроксильной группы в молекуле метанола. Хлорметан представляет собой газ и может быть обнаружен по цвету пламени.
1. В маленькую колбочку или пробирку с отводной трубкой наливают по 1-2 мл метанола, концентрированной соляной кислоты и концентрированной серной кислоты. При несильном нагревании смеси образуется газ, который после вытеснения воздуха собирают в цилиндр или пробирку над водой и поджигают. Хлорметан горит характерным зеленым пламенем, газ можно также поджечь у отводной трубки. Хлорметан не следует выпускать в лабораторию, так как он ядовит.
 2. В пробирку (рис. 24) наливают по 1 мл метанола и концентрированной серной кислоты и добавляют немного (на кончике ножа) прокаленной поваренной соли. Колбочку закрывают пробкой со стеклянной трубкой. При слабом нагревании образуется Хлорметан, который поджигают у отводной трубочки. При внесении в пламя стеклянного или фарфорового предмета образуется копоть, что свидетельствует о горении органического вещества.
2. В пробирку (рис. 24) наливают по 1 мл метанола и концентрированной серной кислоты и добавляют немного (на кончике ножа) прокаленной поваренной соли. Колбочку закрывают пробкой со стеклянной трубкой. При слабом нагревании образуется Хлорметан, который поджигают у отводной трубочки. При внесении в пламя стеклянного или фарфорового предмета образуется копоть, что свидетельствует о горении органического вещества.
По аналогии с образованием бромэтана уравнение реакции для простоты можно представить в следующем виде:
NaCI + H2SO4 à NaHSO4 + НСI
СН3ОН + НСI à СН3СI + H2O
На самом деле реакция идет через образование метилсерной кислоты СН3 — О — SO2OH, которая затем реагирует с хлоридом натрия, образуя Хлорметан и гидросульфат натрия:
CH3OSO2OH + NaCI à СН3СI + NaHSO4
Получение метанола при сухой перегонке дерева. Получение спирта по этому способу состоит из двух частей:
а) сухой перегонки дерева с целью получения дегтярной воды (наряду с углем, дегтем и газом) и б) выделения метанола из дегтярной воды.
Сухую перегонку дерева проводят в круглодонной термостойкой колбе с отводом (рис. 25). В колбу помещают сухие опилки и
стружку и нагревают сначала осторожно, а потом все сильнее и сильнее до тех пор, пока наблюдается обугливание дерева и образование жидких и газообразных продуктов. Приемник для дегтя и дегтярной воды ставят о ледяную воду, а выделяющиеся газы собирают путем вытеснения воды из пробирки.

Когда будет получено достаточное для демонстрации количество жидкости, опыт прекращают. При этом обращают внимание учащихся на расслоение жидкости (внизу — водный слой, сверху — деготь). С помощью делительной воронки отделяют водный слой и лакмусовой бумажкой обнаруживают присутствие кислоты.
Газообразные продукты сухой перегонки дерева собирают в два сосуда (цилиндры или пробирки). Затем в одном из них поджигают газ, который горит синеватым пламенем, а в другой приливают известковую воду для обнаружения углекислого газа в продуктах перегонки.
Для доказательства присутствия метанола в дегтярной воде уксусную кислоту нейтрализуют избытком гидроксида кальция (лакмус!) и, когда кислота будет связана, нагревают жидкость до кипения в пробирке с отводной трубкой. При поджигании пары метанола горят голубоватым пламенем.
Уксусную кислоту превращают в соль с той целью, чтобы она не улетучивалась с метанолом и не мешала распознаванию его по характеру пламени. Эта операция не усложняет понимания учащимися опыта, так как понятие о нейтрализации кислот они имеют. Присутствием ацетона в дегтярной воде при этом опыте можно пренебречь.
Для извлечения метанола берут по возможности большое количество дегтярной воды (например, 100 мл), нейтрализуют ее неболь-
шими порциями мела или известковым молоком, как было указано в предыдущем опыте, и фильтруют. Фильтрат помещают в перегонную колбу, закрывают колбу пробкой с термометром, присоединяют прямой водяной холодильник и отгоняют на водяной бане фракцию до 70—75'С. Метанол получается при этом с примесью воды и ацетона. Ацетон неизбежно летит со спиртом, так как точки кипения их близки (у метанола 65°С, у ацетона 56°С).
Сравнение свойств одноатомных спиртов. Обладая сходными химическими свойствами и составляя один гомологический ряд, предельные одноатомные спирты различаются по физическим свойствам и характеру горения. Это может быть легко показано на опытах.
а) В одинаковые цилиндры или демонстрационные пробирки наливают по 50 мл воды, подкрашенной перманганатом или бихроматом калия и добавляют по 10 мл спиртов, имеющихся в лаборатории, например, метанол, этанол, пропанол-1, пропанол-2, 2-метилпропанш1-2, бутанол, изобутанол и т.д. Энергично встряхивают содержимое цилиндров и дают жидкостям отстояться. Наблюдают, что первые гомологи растворились в воде полностью, бутанол растворяется частично, а другие не растворяются.
б) В небольшие тигли или фарфоровые чашечки наливают спирты в той же последовательности и поджигают. Наблюдают, что с увеличением молекулярного веса и содержания углерода в спиртах светимость пламени возрастает; высшие спирты горят коптящим пламенем. Тушат пламя, покрывая тигли крышками или стеклянными пластинками.
в) В пробирки или химические стаканчики наливают одинаковые количества различных спиртов и помещают небольшие кусочки металлического натрия. Сравнивают скорость выделения водорода в этих случаях.
ГЛИЦЕРИН
Цель опытов с глицерином — ознакомить учащихся с теми свойствами, которые обусловливают применение этого вещества в повседневной жизни, и показать, что глицерин является многоатомным спиртом (имеет как общие с одноатомными спиртами реакции, так и отличные от них).
Растворимость глицерина в воде. В демонстрационную пробирку (или небольшой цилиндр) наливают 5—7 мл глицерина и сверху по стенке прибавляют такой же объем подкрашенной (например, фуксином) воды. При встряхивании жидкость становится однородной и окрашивается равномерно.
Понижение точки замерзания водных растворов глицерина. Водные растворы глицерина (и этиленгликоля) применяются в качестве незамерзающих жидкостей для охлаждения моторов автомашин и самолетов.
а) Пробирку с полученным в предыдущем опыте водным раствором глицерина помещают в охладительную смесь (лед с поваренной солью). Одновременно в смесь помещают пробирку с водой. Через несколько минут убеждаются в том, что вода в пробирке замерзла, раствор же глицерина остался жидким.
б) Ученики могут провести исследование и определить: при каком процентном содержании глицерина в воде раствор перестает замерзать на улице в зимнее время.
Для этого готовят растворы следующих концентраций: 5%, 10%, 15%, 20% и т.д. — выставляют их на улицу в «мягкий» зимний день и затем в морозный. Отмечают температуру воздуха и устанавливают, начиная с какой концентрации растворы глицерина при данной температуре не замерзают.
Гигроскопичность глицерина. Свойство глицерина поглощать влагу и тем самым увлажнять предметы используется, например, для смягчения кожи.
На лист фильтровальной бумаги наносят несколько капель глицерина. На другой лист наносят столько же капель воды. К концу урока убеждаются, что бумага с водой высохла, а бумага с глицерином стала еще более влажной.
Горение глицерина. Демонстрация этого опыта важна тем, что позволяет устранить встречающееся иногда у учащихся неверное представление, будто с увеличением числа атомов углерода в молекуле органического вещества непременно возрастает светимость пламени. Это заключение у них появляется из сопоставления горения метана и этилена. Глицерин содержит три атома углерода в молекуле и тем не менее горит почти бесцветным пламенем, так как он богат кислородом и в процентном отношении содержит углерода меньше, чем этилен.
В небольшой пробирке или в тигельке нагревают до кипения 1 мл глицерина и поджигают выделяющиеся пары. Они горят почти бесцветным пламенем. Может оказаться, что глицерин сразу не загорается из-за присутствия в нем воды; в таком случае он должен быть предварительно обезвожен интенсивным нагреванием.
Реакция глицерина с натрием. Опыт демонстрирует общность свойств глицерина со спиртами.
В пробирку с 1—2 мл глицерина бросают очищенный кусочек натрия величиной с горошину. Пробирку слегка подогревают. Реакция идет вначале медленно, затем все более энергично.
Поджигают выделяющийся водород. Обычно под конец происходит обугливание глицерина.
Реакция с гидроксидом меди. С увеличением числа гидроксильных групп в молекуле вещества возрастает подвижность атомов водорода, т.е. увеличиваются кислотные свойства. Поэтому атомы водорода могут замещаться не только на активные щелочные металлы. Так, например, многоатомные спирты взаимодействуют с гидроксидом меди (уравнение приведено в упрощенном виде):
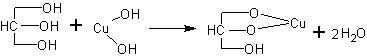
В демонстрационной пробирке (цилиндре, химическом стакане) получают гидроксид меди, добавляя к 4-5 мл раствора медного купороса раствор щелочи до полного осаждения гидроксида. Для успеха опыта щелочь должна быть непременно в избытке, поэтому, ставя опыт, учитель должен соотнести концентрации имеющихся растворов.
Осадок взбалтывают и половину его переносят в другую пробирку. К одной порции добавляют глицерин, пока при взбалтывании осадок гидроксида не исчезнет и Fie образуется темно-синий раствор. Сравнивают окраску раствора с окраской осадка гидроксида в другой пробирке.
Реакция с гидроксидом меди считается качественной реакцией на многоатомные спирты.
ФЕНОЛ
В данном разделе наиболее существенными являются опыты, показывающие растворимость фенола в щелочи, дезинфицирующее действие его и характер взаимного влияния атомов в молекуле фенола.
Растворимость фенола в воде и щелочах. В пробирку с несколькими кристалликами фенола приливают 2-3 мл воды. Пробирку закрывают пробкой и встряхивают. Убеждаются, что фенол не полностью растворился в воде и образовал непрозрачную эмульсию. Дают эмульсии отстояться, жидкость расслаивается: внизу образуется раствор воды в феноле, вверху — раствор фенола в воде.
Содержимое пробирки снова взбалтывают и к эмульсии фено-
ла прибавляют по каплям раствор щелочи. Раствор становится прозрачным, так как образующийся фенолят растворим в воде:
С6Н5ОН + NaOH à С6Н5ОNa + Н2О
В этой реакции фенол проявляет кислотные свойства. Это подтверждается и тем, что при действии кислот (добавляют по каплям соляную кислоту) фенол снова выделяется из раствора:
C6H5ONa + HCI à C6H5ONa + NaCl
Фенол — слабая кислота. Для приблизительного определения силы кислоты достаточно установить, какими кислотами она может вытесняться из солей. Фенол слабее угольной кислоты, поэтому при действии угольной кислоты на фенолят натрия образуется фенол:
С6Н5ОNa + (H2CO3) à С6Н5ОН + NaHCO3
Раствор фенолята натрия получают, прибавляя раствор щелочи к эмульсии фенола (избегать избытка щелочи!). Далее в него пропускают углекислый газ из аппарата Киппа. Образуется муть вследствие выделения свободного фенола.
Реакция фенола с бромной водой. Опыты, на которых можно развить идею о взаимном влиянии атомов в молекулах, имеют большое воспитательное значение. Взаимное влияние атомов можно рассмотреть на примере фенола после ознакомления с его кислотными свойствами.
Большая в сравнении со спиртами подвижность гидроксильного атома водорода в молекуле фенола (реакция со щелочью) обусловлена влиянием на гидроксильную группу соединенного с ней бензольного кольца. Гидроксильная группа в свою очередь влияет на бензольное ядро, ослабляя в орто- и пара-положениях связи атомов водорода с атомами углерода, вследствие чего атомы водорода значительно легче, чем в бензоле, замещаются атомами брома. Бензол, как известно, не реагирует с бромной водой (реагирует с чистым бромом в присутствии железа), фенол же легко реагирует с бромной водой, сразу замещая на бром три атома водорода в своей молекуле.
В демонстрационную пробирку берут немного (на кончике ножа) фенола и добавляют воды столько, чтобы при взбалтывании получился раствор (а не эмульсия) фенола. Далее прибавляют насыщенную бромную воду. Сначала образуется белая муть, а затем осадок трибромфенола:
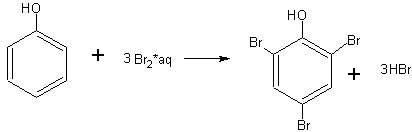
Трибромфенол обладает устойчивым неприятным запахом, поэтому надо остерегаться попадания его на руки и одежду.
Качественная реакция фенола. Характерной качественной реакцией на фенолы является взаимодействие с хлоридом железа(III). К разбавленному раствору (не эмульсии!) фенола добавляют несколько капель раствора хлорида железа FeCI3, Жидкость окрашивается в темно-фиолетовый цвет (белый экран!).
Дезинфицирующее действие фенола. Дезинфицирующее действие фенола основано на том, что он свертывает белок, чем прекращает жизнедеятельность бактерий.
Это действие наблюдают, прибавляя к небольшому количеству раствора куриного яйца в пробирке расплавленный фенол и взбалтывая смесь.
Следует указать учащимся, что этим же свойством фенола обусловливается появление белых пятен на коже рук при неосторожном обращении с ним.
Нитрование фенола. При нитровании фенола образуется тринитрофенол — пикриновая кислота:
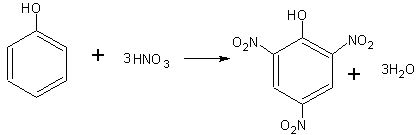
К 3 мл концентрированной азотной кислоты в пробирке приливают 1 мл (не больше) воды и в разбавленную, таким образом кислоту вносят по каплям 0,5 мл расплавленного фенола. Полученную смесь взбалтывают и нагревают до кипения. При последующем охлаждении образуются красивые желтые кристаллы пикриновой кислоты.
Получение фенола из салициловой кислоты. Способы получения фенола не рассматриваются в школьном курсе химии. На внеклассных занятиях (лучше после изучения кислот) можно поставить опыт получения фенола из салициловой кислоты. Существует большая аналогия между получением метана, бензола и фенола при
взаимодействии соответствующих кислот или их солей со щелочью. Везде происходит образование карбоната и соответствующего углеводорода или его производного:
CH3COONa + NaOH à CH4 + Na2CO3
C6H5COONa + NaOH à C6H6 + Na2CO3
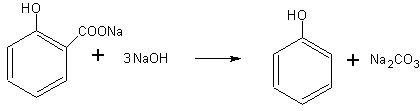
Для получения фенола можно воспользоваться салицилатом натрия или непосредственно салициловой кислотой. Эти вещества могут быть приобретены в аптеке.
В пробирку с отводной трубкой помещают смесь примерно одинаковых объемов салициловой кислоты, гидроксида натрия и оксида кальция. Смесь нагревают, опустив отводную трубку в известковую воду. Убеждаются в выделении углекислого газа. Затем отводную трубку опускают в сухую пробирку и отгоняют столько фенола, сколько позволяет исходное количество салициловой кислоты. Убеждаются в получении фенола по запаху и по реакции с раствором хлорида железа. Применять холодильник приэтом, разумеется, нет необходимости.
ПРОСТЫЕ ЭФИРЫ
Простые эфиры рассматриваются на уроках химии в общих чертах. Можно экспериментально ознакомить учащихся лишь с важнейшим представителем этого класса соединений — диэтиловым (серным) эфиром. Наибольшее значение здесь будут иметь опыты, иллюстрирующие некоторые физические свойства эфира и получение его из этанола. Лабораторные опыты с эфиром ставить не следует, так как пары его огнеопасны.
Низкая температура кипения эфира. Эфир является одной из жидкостей, обладающих низкой температурой кипения.
Нагревают в химическом стакане воду примерно до 50'С. В нагретую воду вносят пробирку с эфиром — эфир закипает. Одновременно можно внести пробирки с другими известными учащимся жидкостями (бензол, этанол) — кипение жидкостей не наступает.
Охлажд
Дата добавления: 2018-11-26; просмотров: 1586;











