НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
При изучении непредельных углеводородов эксперимент ставится преимущественно лишь с двумя веществами — этиленом и ацетиленом.
Многие опыты с этими веществами напоминают работы, выполненные с метаном (горение, взрыв и др.); такие опыты здесь не составляют уже основного содержания эксперимента. Наибольшее значение в этой теме приобретает эксперимент, развивающий представление учащихся о строении вещества, способствующий углублению их понятия о теории строения органических соединений. Сюда относятся опыты, устанавливающие связь строения молекул со свойствами вещества, т.е. иллюстрирующие специфические свойства непредельных соединений.
Этилен
Опыты с этиленом даются здесь в иной последовательности, чем опыты с метаном. Учитель может поставить их, пользуясь заранее
собранным этиленом, и лишь затем показать получение этого вещества на уроке. Если, однако, изучение этилена учитель начинает с получения его, то он без труда сможет изменить предлагаемый ниже порядок опытов.
Горение этилена. Горение этилена и другие опыты с ним могут быть поставлены в нескольких вариантах. Так, например, при изучении нового материала сжигание этилена, а также реакции его с бромом и с раствором перманганата калия можно провести в цилиндрах; при опросе же учащихся и повторении эти опыты можно провести путем поджигания газа у отводной трубки газометра и пропускания газа через соответствующие растворы.
1. Открывают стоящий на столе цилиндр с этиленом и поджигают газ. Газ горит светящим пламенем. По мере сгорания газа пламя уходит в цилиндр и становится малозаметным для учащихся. Чтобы получить большой факел пламени, как и в аналогичном опыте с метаном (рис. 4), в цилиндр вливают воду с целью вытеснения из него этилена. На воздухе горение этилена происходит более интенсивно.
Для доказательства наличия углерода в составе этилена можно держать над пламенем опрокинутый стакан, сполоснутый баритовой или известковой водой. Очевидно, доказательство наличия водорода по образованию воды при горении в данном случае было бы неубедительным, так как учащиеся могут прийти к выводу о том, что появление влаги на стенках стакана обусловливается испарением воды, вливаемой в цилиндр.
2. Если демонстрация опытов начинается с получения этилена, то газ поджигают у отводной трубки прибора (после проверки на полноту вытеснения воздуха). Чтобы газ горел ровным пламенем, в сгибе отводной трубки при вынимании ее из ванны не должна оставаться вода. Если газ был пропущен через осушитель (концентрированную серную кислоту), то в этом опыте легко доказать наличие водорода в составе этилена. Для этого держат над пламенем перевернутый сухой стакан: он покрывается каплями влаги.
При демонстрации горения этилена следует разъяснить учащимся, почему этилен, в отличие от метана, горит светящим пламенем.
Взрыв смеси этилена с кислородом. После демонстрации горения этилена учащиеся иногда спрашивают, образует ли этилен взрывчатую смесь с кислородом и воздухом подобно метану. Для взрыва этилена согласно уравнению реакции берут другие объемные соотношения газов, нежели при взрыве метана. При взрыве с кислородом теоретическое соотношение должно быть 1 ; 3, при взрыве с воздухом —1:15.
С2Н4 + ЗО2 à 2СO2 + 2Н2О
Производят взрыв в склянке так же, как с метаном. Склянка, разделенная метками по одной стороне (для опыта с метаном) на 3 части, с другой стороны должна быть разделена для данного опыта на 4 части. В склянку по способу вытеснения воды набирают вначале кислород, затем этилен. В опыте соблюдают те же предосторожности, что и при взрыве метана! Взрыв получается более сильный, чем у метана.
Опыты горения этилена показали, что в состав его входят водород и углерод. Вес 1 л газа при нормальных условиях равен 1,25 г. Молекулярный вес этилена, следовательно, 22, 4 • 1,25 = 28.
Уже простые соображения показывают, что в молекуле газа должно содержаться 2 атома углерода (12 • 2 = 24) и, следовательно, 4 атома водорода (28 — 24 = 4).
Реакция этилена с бромом. Ознакомлению учащихся с этой реакцией должно быть уделено особое внимание, так как она наиболее типична для непредельных углеводородов и вместе с тем сравнительно легко осуществима в школьных условиях. Выполнение опыта облегчается тем, что реакция идет как с чистым бромом, так и с бромной водой.
Опыт может ставиться с различными целями: в связи с обоснованием структурной формулы этилена; для показа химических свойств вещества; для открытия непредельного соединения; для получения дибромэтана.
1. После того как установлена молекулярная формула этилена, может быть поставлен опыт, на базе которого можно сделать заключение о структурной формуле этого вещества. Учащимся сообщается, что опыт будет заключаться в исследовании реакции этилена с бромом, которая является для изучаемого вещества наиболее характерной.
 Собирают прибор, как показано на рис. 10. Колбу (из прочного стекла) предварительно заполняют этиленом по способу вытеснения воды и сначала закрывают ее в ванне обычной пробкой, а затем быстро заменяют эту пробку на пробку с двумя отверстиями для канальной воронки и отводной трубки. В стакан наливают воду с таким расчетом, чтобы объем ее был не меньше емкости колбы.
Собирают прибор, как показано на рис. 10. Колбу (из прочного стекла) предварительно заполняют этиленом по способу вытеснения воды и сначала закрывают ее в ванне обычной пробкой, а затем быстро заменяют эту пробку на пробку с двумя отверстиями для канальной воронки и отводной трубки. В стакан наливают воду с таким расчетом, чтобы объем ее был не меньше емкости колбы.
В колбу с этиленом постепенно при охлаждении (водяная баня) прикалывают бром и встряхивают ее содержи-
мое. Прибавление брома продолжают до тех пор, пока с ним не прореагирует весь этилен, т.е. пока новые капли брома не будут оставаться без изменений. Наблюдают образование на стенках колбы маслянистых капель нового вещества. Отмечают по делениям объем вступившего в реакцию брома и вычисляют его весовое количество. Затем опускают трубку в сосуд с водой и, если колба достаточно охладилась, открывают зажим. Вода с силой устремляется в колбу и заполняет ее почти целиком.
Учитель сообщает, что, как показывает опыт, в результате этой реакции образуется одно вещество, которое учащиеся видят на стенках колбы, других веществ не найдено. Поэтому, когда этилен вступит в реакцию, в колбе образуется разреженное пространство, куда и устремляется вода под давлением атмосферного воздуха.
Каков же состав нового вещества, получившегося при соединении этилена с бромом? Учащиеся сравнивают количество прореагировавших этилена и брома (в молях) и находят, что на каждую молекулу этилена расходовалась молекула брома. В таком случае уравнение реакции должно быть написано в следующем виде:
С2Н4 + Вг2 à С2Н4Вг2
Если полученное вещество, сообщает преподаватель, собрать и подвергнуть анализу, то формула его С2Н4Вг2 подтверждается. Это вещество — дибромэтан, структурная формула которого
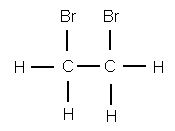
Чтобы представить себе строение этилена, надо, следовательно, убрать из молекулы два атома брома. Тогда освободившиеся от атомов брома валентности углерода смыкаются друг с другом и образуют двойную связь
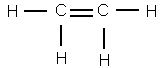
Это и будет структурная формула этилена.
2. Если постановка предыдущего опыта затрудняет учителя, опыт может быть показан в упрощенном виде как иллюстрация химических свойств этилена.
В цилиндр с этиленом наливают бромной воды, закрывают его пробкой или стеклянной притертой пластинкой (не рукой!) и взбалтывают. Окраска брома очень быстро исчезает. Обращают внимание на звук врывающегося в цилиндр воздуха при открывании пробки, что говорит об израсходовании газа на реакцию.
Учитель сообщает, что полученное вещество изучено и оказалось известным учащимся (теоретически) галогенопроизводным этана — дибромэтаном. Составляют уравнение реакции в обычном и в структурном виде и делают заключение о структурной формуле этилена, как описано выше.
Чтобы сделать опыт хорошо видимым, следует пользоваться по возможности концентрированной бромной водой и цилиндрами большого диаметра, тогда изменение окраски воды будет разительным.
Учителя нередко задают вопрос: сколько бромной воды следует приливать в цилиндр с газом? Точного ответа здесь дать нельзя, так как цилиндры могут быть взяты разных объемов, и бромная вода обычно готовится неопределенной концентрации. Большой точности опыт, однако, и не требует. Если бромной воды будет взято меньше, чем полагается по стехиометрическому соотношению, она полностью обесцветится, а остаток этилена на результат наблюдения не повлияет. Если же бромной воды будет взято несколько больше, чем полагается, и бром вступит в реакцию не полностью, все же концентрация его снижается настолько, что вода кажется бесцветной или значительно обесцветившейся. Разумеется, до занятия надо проверить опыт, чтобы установить нужное количество бромной воды.
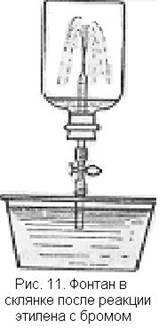 3. Реакция этилена с бромом может быть использована для проведения внешне эффектного опыта. Он основан на том, что при реакции этилена с бромом в замкнутом сосуде образуется разреженное пространство.
3. Реакция этилена с бромом может быть использована для проведения внешне эффектного опыта. Он основан на том, что при реакции этилена с бромом в замкнутом сосуде образуется разреженное пространство.
Толстостенный сосуд емкостью 0,5—1 л наполняют этиленом, в него осторожно помещают 1—2 ампулы с бромом в зависимости от объема склянки и величины ампул и закрывают пробкой, через которую проходит стеклянная трубка с краном. Встряхивают склянку так, чтобы обломились концы ампул. Склянка заполняется парами брома, окраска которых, однако, постепенно исчезает, так как бром вступает в реакцию с этиленом. В сосуде образуется разреженное пространство. Конец стеклянной трубки опускают в чашку с подкрашенной водой и открывают кран (рис. 11). Вода с силой устремляется в склянку и бьет фонтаном.
Дата добавления: 2018-11-26; просмотров: 979;











