Окисление этилена раствором перманганата.
1. В заготовленный цилиндр с этиленом наливают несколько миллилитров раствора перманганата калия, закрывают цилиндр пробкой или стеклянной пластинкой и встряхивают. Если раствора прилито не слишком много, то происходит полное обесцвечивание, в противном случае раствор становится бурым.
2. В бокал, демонстрационную пробирку или цилиндр с раствором перманганата калия пропускают этилен из прибора, раствор обесцвечивается.
И в том и в другом опыте лучше брать слабый раствор перманганата калия — прозрачный, но не темный. Тогда при взаимодействии с этиленом происходит не побурение раствора, а почти полное обесцвечивание его, что лучше убеждает учащихся.
Реакция этилена с хлором (реакция присоединения). Взаимодействие этилена с хлором
С2Н4 + СI2 à С2Н4СI2
идет, как известно, медленнее, чем с бромом. Это несколько усложняет постановку опытов в школьных условиях. Однако ознакомить учащихся с этой реакцией, хотя бы на внеклассных занятиях, следует, так как она имеет важное промышленное значение как способ получения распространенного растворителя — дихлорэтана и иллюстрирует различие в действии хлора и брома.
Цилиндр, содержащий равные объемы этилена и хлора, закрепляют в штативе опрокинутым в ванну с насыщенным раствором поваренной соли. Наблюдают поднятие уровня жидкости в цилиндре, ослабление, а затем и исчезновение окраски хлора. На стенках обнаруживают маслянистые капли дихлорэтана.
Чтобы учащиеся не сделали заключения, будто вода поднимается вследствие растворимости газов в ней, может быть поставлен контрольный опыт. В раствор поваренной соли опускают цилиндр с хлором и цилиндр с этиленом. Уровень жидкости в них почти не изменяется, и окраска хлора не исчезает. Причина замены воды раствором соли была объяснена выше (с. 33).
Наполнение цилиндра смесью газов может быть произведено двояко:
а) В цилиндр по способу вытеснения воды (раствора NaCl) пропускают вначале хлор до метки, разделяющей цилиндр пополам, затем пропускают этилен до полного вытеснения воды. Цилиндр закрывают под водой пробкой и, перевертывая его несколько раз, перемешивают газы.
б) В один цилиндр с пришлифованными краями собирают этилен, в другой такой же цилиндр — хлор. Цилиндры соединяют от-
верстиями и перемешивают газы. Когда газы примут одинаковую окраску, цилиндры разъединяют и закрывают пробками. Один цилиндр со смесью газов используют для описанного выше опыта, второй цилиндр — для демонстрации горения смеси этилена с хлором (с. 46). Хлор для опытов может быть получен окислением концентрированной соляной кислоты оксидом марганца МпО2, перманганатом калия КМпО4 или бихроматом калия К2Сг2О7.
Горение этилена в хлоре. При поджигании этилен горит в хлоре, образуя хлористый водород и выделяя свободный углерод:
С2Н4 + 2CI à 2С + 4НСI
1. В цилиндр или стакан с хлором опускают изогнутую трубку с горящим этиленом (этилен в трубку может поступать из прибора или из газометра). Этилен продолжает гореть в хлоре, образуя много копоти. Опыт проводят под тягой.
Хлор может быть собран в цилиндр заранее или же получен непосредственно во время урока. Для этого в цилиндр насыпают измельченного перманганата калия столько, чтобы только покрылось дно, и добавляют 2—3 мл концентрированной соляной кислоты. Цилиндр постепенно заполняется хлором. Когда хлор начинает подходить к отверстию цилиндра, в него вводят очень медленно трубку с горящим этиленом, не погружая ее глубоко в цилиндр.
2. Поджигают смесь этилена с хлором, собранную в цилиндре. Образуется большое коптящее пламя. Основываясь на уравнении реакции, учащиеся должны сказать, в каких объемных отношениях должны быть смешаны газы, чтобы горение прошло полностью.
Получение этилена из этилового спирта в присутствии серной кислоты. Наиболее доступный и распространенный лабораторный способ получения этилена — нагревание смеси этилового спирта с концентрированной серной кислотой. Однако первоначально взаимодействие спирта с кислотой приводит к образованию сложного эфира, который затем при нагревании распадается на этилен и серную кислоту:
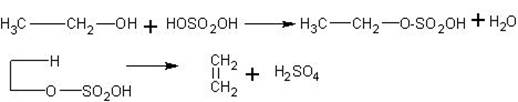
Таким образом, серная кислота выходит из реакции, т.е. выполняет роль катализатора.
Уравнение реакции получения этилена дается учащимся лишь в суммарном виде:
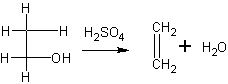
Чтобы увеличить выход этилена и тем самым обеспечить проведение всех опытов с ним при экономном расходовании спирта, необходимо учесть следующее.
Этилен, как было показано выше, образуется из кислого этилового эфира серной кислоты (этилсерной кислоты). Если в реакцию этерификации вступит не весь спирт, то при нагревании смеси он будет отгоняться вместе с этиленом, т.е. будет потерян для реакции. Реакция этерификации, как известно, обратима, и при эквимолекулярном соотношении спирта и серной кислоты, кроме эфира, в смеси будет содержаться известное количество спирта и кислоты. Чтобы сдвинуть равновесие в сторону образования эфира и полнее использовать спирт, следует увеличить содержание серной кислоты. Опыт показывает, что при увеличении количества кислоты количество этерифицируюшегося спирта в начале заметно возрастает, а после того как соотношение количеств кислоты и спирта достигнет примерно 3:1, оно возрастает уже незначительно. Поэтому практически наилучшие результаты получаются, если на 1 моль (46 г) спирта брать 3 моля (3 • 98 = 294 г) серной кислоты или на 1 объем спирта брать примерно тройной объем концентрированной серной кислоты. В таком случае спирт будет этерифицирован в значительной своей части, потери его будут очень невелики и выход этилена возрастет.
По мере разложения эфира концентрация кислоты будет увеличиваться, и условия для более полного использования спирта будут улучшаться.
Чтобы реакция шла без обильного пенообразования и сильных толчков, к смеси добавляют битое стекло или фарфоровую крошку, обеспечивающие равномерное кипение.
Демонстрационный опыт проводят следующим образом. В колбу емкостью 300-500 мл наливают 20 мл этилового спирта и постепенно добавляют 60 мл концентрированной серной кислоты. Смесь взбалтывают и охлаждают в струе воды. Затем насыпают фарфоровую крошку, закрывают колбу плотно пробкой с отводной трубкой и присоединяют промывные склянки (лучше склянки Тищенко) с концентрированной серной кислотой и с 10-процентным раствором щелочи. К склянке со щелочью присоединяют стеклянную трубку, опущенную в ванночку с водой для собирания газа (рис. 12).
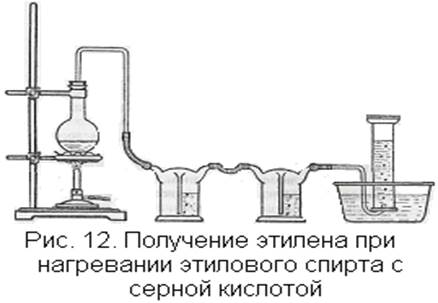
Колбу укрепляют в штативе на асбестированной сетке или на песочной бане и нагревают тем или иным способом, предварительно проверив прибор, как обычно, на герметичность. Вначале нагревание ведут довольно интенсивно, чтобы быстро перейти «порог» образования этилового эфира (140°С), затем, когда начнет выделяться этилен, нагревают медленно, поддерживая равномерный ток газа и по возможности не допуская вспенивания.
Когда проба газа в пробирке покажет, что воздух полностью вытеснен из прибора, этилен собирают в цилиндры и газометр, как было описано выше, или непосредственно используют для опытов: поджигают у отводной трубки, пропускают и бромную воду и т.п. Для прекращения реакции удаляют газоотводную трубку из ванны, отделяют промывные склянки от колбы и только после этого прекращают нагревание.
При получении больших количеств этилена (например, при наполнении газометра для опытов, проводимых в нескольких классах) следует взять больше исходной смеси веществ.
2. Для постановки в качестве лабораторного опыта эксперимент можно значительно упростить. В пробирку, закрепленную в штативе, наливают 1 мл этилового спирта и осторожно прилипают 3 мл концентрированной серной кислоты. Добавляют несколько фарфоровых крупинок и закрывают пробирку пробкой, в которую вставлен узкий конец хлоркальциевой трубки, содержащей патрон-
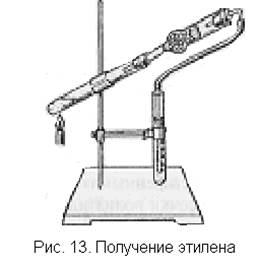 ную известь (для улавливания оксидов серы и углерода). Широкий конец хлоркальциевой трубки закрывают пробкой с газоотводной трубкой, на конец которой надет резиновый шланг. Содержимое пробирки осторожно нагревают. Выждав некоторое время, необходимое для вытеснения из пробирки воздуха, этилен собирают в другую пробирку по принципу вытеснения или пропускают в реакционный раствор брома или перманганата калия (рис. 13).
ную известь (для улавливания оксидов серы и углерода). Широкий конец хлоркальциевой трубки закрывают пробкой с газоотводной трубкой, на конец которой надет резиновый шланг. Содержимое пробирки осторожно нагревают. Выждав некоторое время, необходимое для вытеснения из пробирки воздуха, этилен собирают в другую пробирку по принципу вытеснения или пропускают в реакционный раствор брома или перманганата калия (рис. 13).
Получение этилена из дибромэтана. Этой реакцией можно воспользоваться для подтверждения структурной формулы этилена. После того как из этилена получен дибромэтан С2Н4Вг2, учитель может показать обратную реакцию — отщепление атомов брома, в результате чего снова образуется знакомый учащимся этилен.
Так как строение дибромэтана учащимся известно, то естественно предположить, что после удаления атомов брома за счет освободившихся валентностей атомов углерода образуется двойная связь, и, таким образом, углерод остается четырехвалентным.
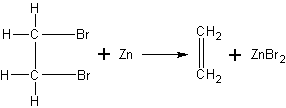
В маленькую колбочку или пробирку с отводной трубкой наливают 2 мл дибромэтана (он может быть в значительных количествах получен учащимися в химическом кружке), прибавляют столько же спирта и несколько мелких кусочков цинка. Смесь нагревают до начала реакции. Далее нагревание происходит за счет теплоты, выделяющейся при реакции. Образующийся газ собирают по способу вытеснения воды и поджигают или пропускают в бромную воду.
Опыты с полиэтиленом. Практически наиболее важными свойствами полиэтилена (—СН2—СН2—)n являются его термопластичность, высокая химическая стойкость, нерастворимость и отсутствие электропроводности.
а) Изделие из полиэтилена (пластинку, трубочку, пробку от бутылки и т.п.) нагревают над пламенем горелки. Замечают, что
материал быстро размягчается. Изменяют его форму и дают изделию остыть. Приданная ему форма при этом прочно закрепляется.
При несколько более сильном нагревании полиэтилен плавится. Будучи подожжен, он горит синеватым пламенем без копоти.
б) Накладывают одну полиэтиленовую пленку на край другой такой же пленки, покрывают их листом бумаги и проводят по бумаге над местом соединения пленок несильно нагретым паяльником или другим металлическим предметом. Пленки оказываются прочно «сваренными».
в) Кусочки полиэтилена помешают в пробирки с концентрированной серной кислотой, с концентрированной азотной кислотой, с раствором щелочи и раствором перманганата калия. Убеждаются, что ни в одной из пробирок химическая реакция не происходит.
г) Кусочки полиэтилена помещают в пробирки с ацетоном, дихлорэтаном и этиловым спиртом. За время урока ни в одной из жидкостей не происходит растворения полиэтилена.
д) К палочке, пластинке или пленке из полиэтилена прикасаются электродами от прибора для изучения электропроводности. Убеждаются, что полиэтилен не проводит электрического тока. Для сравнения показывают, что ток проходит через металлическое изделие и через раствор электролита.
Опыты с другими углеводородами, содержащими двойную связь.
Чтобы у учащихся создать представление о том, что изученные реакции присущи не только этилену, но и всем углеводородам с двойной связью, можно продемонстрировать опыты с другими непредельными соединениями. Подобные опыты могут быть использованы для распознавания непредельных углеводородов среди других веществ.
Для этой цели сравнительно доступными могут быть скипидар и гексен. Скипидар не относится к углеводородам ряда этилена, но, как непредельное соединение, он обесцвечивает бромную воду и раствор перманганата калия. Гексен же является ярким представителем алкенов. В качестве углеводородов, не дающих реакции с бромной водой и перманганатом калия, могут быть взяты гексан и бензин.
АЦЕТИЛЕН
Опыты получения ацетилена и исследования его свойств демонстрируются одновременно. Заготавливать ацетилен для урока заранее и хранить его в газометре не следует ввиду опасности взрыва.
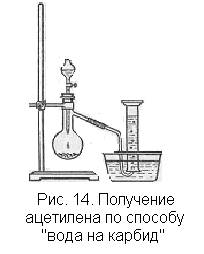 Получение ацетилена. Самый доступный способ получения ацетилена — взаимодействие карбида кальция с водой:
Получение ацетилена. Самый доступный способ получения ацетилена — взаимодействие карбида кальция с водой:
СаС2 + 2Н2O à С2Н2 + Са(ОН)2
Колбу для реакции следует брать не слишком малого объема, так как при реакции происходит вспучивание образующейся густой жидкости и пену может погнать газом по отводной трубке. В случае применения слишком большой колбы пройдет много времени, пока из прибора не будет вытеснен весь воздух, и если ждать этого момента, то произойдет большая потеря ацетилена. Удобно воспользоваться колбой емкостью 250 мл. В случае применения колбы большей емкости опыты с ацетиленом можно начинать с реакций, не требующих вытеснения воздуха, что даст возможность провести их достаточно экономно.
При приливании воды к карбиду кальция реакция идет всегда очень бурно; ацетилен поэтому расходуется непроизвольно, и его может не хватить для показа всех намеченных опытов. Получить более спокойный и равномерный ток ацетилена можно двумя способами: добавить к карбиду кальция этиловый спирт и лишь затем пускать воду или же вместо воды воспользоваться насыщенным раствором поваренной соли.
В колбу помещают 7—8 кусочков карбида кальция величиной с горошину, вставляют плотно пробку с воронкой, наливают в воронку насыщенный раствор поваренной соли и пускают несколько капель его в колбу. Дальнейшее прибавление раствора производят так, чтобы установился равномерный ток газа со скоростью, позволяющей считать пузырьки. Обращают внимание учащихся на то, что реакция, в отличие от получения этилена и метана, идет без подогрева.
Образующийся газ собирают в цилиндры по способу вытеснения воды (после проверки на полноту вытеснения воздуха) или же непосредственно используют для соответствующих опытов. Ввиду заметной растворимости ацетилена в воде иногда рекомендуют собирать его над раствором поваренной соли, однако, как показывает опыт, вполне можно пользоваться и обычной водой.
Растворение ацетилена в воде. Ацетилен растворяется в воде лучше метана и этилена.
1. Пропускают ацетилен через воду в пробирке в течение нескольких минут. После этого нагревают воду до кипения и к отверстию пробирки подносят зажженную лучинку. Выделяющийся из воды ацетилен вспыхивает.
2. Цилиндр или пробирку с чистым (без воздуха) ацетиленом опрокидывают отверстием в стакан с подкрашенной холодной водой. При покачивании цилиндра (пробирки) уровень воды в нем заметно поднимается. Это явление будет более наглядным, если цилиндр в таком положении закрепить в штативе и оставить до следующего занятия.
Растворение ацетилена в ацетоне. Ацетилен хорошо растворяется в ацетоне. В виде такого раствора он и хранится обычно в стальных баллонах (с пористым наполнителем).
В небольшой цилиндр с ацетиленом наливают 3—4 мл ацетона. Цилиндр закрывают пробкой, встряхивают несколько раз и опрокидывают в ванну с подкрашенной водой. При открывании пробки вода поднимается в цилиндре.
Горение ацетилена. Полное сгорание ацетилена выражается уравнением:
2С2Н2 + 5O2 à 4СO2 + 2Н2O
Внешняя картина горения и развиваемая при этом температура в сильной степени зависят от объемного соотношения газов.
Поджигают ацетилен, собранный в цилиндр, по способу вытеснения воды. Газ горит коптящим пламенем. По мере продвижения пламени внутрь цилиндра образование копоти усиливается, так как горение в цилиндре идет еще при большем недостатке кислорода. Поджигают ацетилен и у отводной трубки прибора (рис. 14) обращают внимание на то, что чем меньше отверстие трубки, тем газ горит менее коптящим пламенем, а в тонкой струйке газа происходит полное сгорание.
Взрыв ацетилена с кислородом. Смесь ацетилена с кислородом при поджигании взрывается с очень большой силой. Поэтому опыт можно производить в стальном цилиндре или в такой оболочке, разрыв которой неопасен. Лучше всего взрыв ацетилена показать в мыльных пузырях.
В мыльную воду, заготовленную заранее в железной чашке из расчета 1 г мыла на 30—40 мл воды и 4—5 мл глицерина, пропускают одновременно ацетилен из прибора и кислород из газометра. Уносят приборы со стола и поджигают длинной лучинкой образовавшиеся пузырьки со смесью газов. Происходит сильный, но безопасный взрыв.
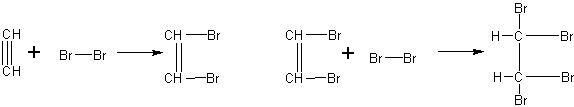
Реакция ацетилена с бромом и раствором перманганата калия.Опыты, иллюстрирующие непредельность ацетилена, могут быть осуществлены двумя способами: а) пропусканием ацетилена в бромную воду и раствор перманганата калия, б) приливанием этих растворов в цилиндры с ацетиленом.
При демонстрации опытов первым способом обесцвечивание растворов (особенно бромной воды) наступает довольно медленно. Перемешивание растворов стеклянной палочкой несколько ускоряет процесс.
При демонстрации опытов вторым способом встряхивают газ с растворами в цилиндрах; обесцвечивание при этом наступает быстрее.
Исходя из строения ацетилена, учащиеся обычно правильно составляют уравнения реакций его с бромом:
Реакция ацетилена с перманганатом калия, как и реакция этилена, здесь может быть рассмотрена лишь в общих чертах.
Если реакция ацетилена с бромом и перманганатом калия демонстрируется способом пропускания газа через растворы, то время, в течение которого произойдет обесцвечивание растворов (сравните с этиленом), может быть использовано для разбора реакции. Такой опыт следует вести под тягой, так как сравнительно много ацетилена (с ядовитыми примесями) выделяется в атмосферу. Обсуждение опыта может быть начато примерно так: «Исходя из наличия тройной связи в молекуле ацетилена, мы высказываем предположение, что он должен легко окисляться и вступать в реакции присоединения. По какому признаку мы сможем определить, пойдут ли эти реакции в поставленном опыте?» После ответа учащихся учитель ставит вопрос: «Если произойдет обесцвечивание растворов, то как можно было бы выразить эти реакции уравнениями?»
Горение ацетилена в хлоре. Ацетилен, как и другие углеводороды, горит в хлоре, образуя хлористый водород и уголь:
С2Н2 + СI2 à 2С + 2НСI
1. В цилиндр с хлором медленно вводят изогнутую стеклянную трубку с горящим ацетиленом. Ацетилен продолжает гореть в хлоре, образуя копоть. Наполнять цилиндр хлором можно на уроке, насыпав в него немного толченого перманганата калия и приливая концентрированную соляную кислоту.
2. В цилиндр с хлором постепенно вводят изогнутую трубку, по которой поступает ацетилен (предварительно проверенный на чи-
стоту). Ацетилен воспламеняется в хлоре. Опыт иллюстрирует большую химическую активность ацетилена.
3. В стеклянный цилиндр насыпают немного хлорной извести и обливают ее разбавленной соляной кислотой. Туда же бросают несколько кусочков карбида кальция. Через некоторое время в цилиндре наблюдают вспышки пламени, то угасающие, то вновь появляющиеся и перекатывающиеся сверху вниз.
При реакции хлорной извести с кислотой выделяется хлор:
CaCIOCl + 2НСI à СаСI2 + Н2О + СI2
а при реакции карбида кальция с водой — ацетилен (ем. с. 51). Ацетилен и хлор вступают в реакцию присоединения, от теплоты которой происходит воспламенение ацетилена в хлоре (в цилиндре) и в воздухе (у отверстия цилиндра). Хлорная известь здесь взята потому, что она образует хлор при реакции с разбавленной соляной кислотой, тогда как перманганат калия выделяет его при реакции с концентрированной кислотой. Присутствие же свободной воды необходимо для получения достаточно большого количества ацетилена.
Опыты с полихлорвинилом. При ознакомлении с полихлорвинилом следует рассмотреть отношение его к нагреванию, к химическим реагентам и растворителям. Последние два опыта здесь не описываются, так как ставятся они так же, как с полиэтиленом.
а) Кусочки винипласта или полихлорвиниловой пленки (клеенки, изоляции) нагревают осторожно в пробирке или фарфоровой чашке.
Убеждаются, что полимер не переходит в жидкое состояние, а разлагается. К выделяющимся газообразным продуктам разложения подносят влажную лакмусовую бумажку и затем палочку, смоченную раствором аммиака. Наблюдают покраснение бумажки в первом случае и образование белого дымка во втором. Делают вывод о выделении хлористого водорода при разложении полихлорвинила.
б) Кусочки полихлорвинила нагревают в пробирке, закрытой пробкой с отводной трубкой. Газообразные продукты разложения отводят в пробирку с водой. К полученному водному раствору приливают немного раствора нитрата серебра и 1—2 капли азотной кислоты. Наблюдают образование осадка хлорида серебра, что говорит о выделении хлористого водорода при разложении полимера.
КАУЧУК
Опыты с каучуком проводятся с целью показан, отношение его к органическим растворителям, принадлежность к непредельным
соединениям и отличие свойств вулканизированного каучука и резины.
Отношение каучука и резины к растворителям. Невулканизированный каучук растворяется во многих органических растворителях; вулканизированный каучук (резина) в той или иной степени растворяет в себе эти вещества, от чего увеличивается в объеме (как говорят, «набухает»).
В две пробирки с бензином или бензолом помещают по одинаковому кусочку сырого (невулканизированного) каучука и резины (например, от резиновой пробки или галоши). Пробирки закрывают корковыми пробками и оставляют для дальнейшего наблюдения. На следующем занятии обнаруживают, что в одной пробирке каучук растворяется, а в другой пробирке резина набухает.
Взаимодействие каучука с бромом. Вследствие наличия двойных связей каучук легко присоединяет галогены. Этим объясняется, например, затвердение каучуковых пробок и трубок при работе с галогенами.
Готовят раствор сырого (невулканизированного) каучука в бензине, свободном от непредельных соединений, или в бензоле (что удобнее, так как он обычно не требует предварительной очистки). Это может быть достигнуто кипячением тонко нарезанных кусочков каучука с растворителем в колбе с обратным холодильником или настаиванием (без нагревания) в течение нескольких суток.
В большую пробирку с раствором каучука приливают раствор брома в бензоле, бензине или хлороформе (чтобы в пробирке могла образоваться гомогенная смесь). При встряхивании содержимого пробирки окраска брома исчезает.
Для опыта можно воспользоваться также бромной водой. При сильном взбалтывании с раствором каучука бромная вода также обесцвечивается.
Разложение каучука при нагревании. Каучук при нагревании разлагается на продукты с меньшей молекулярной массой.
Образующиеся вещества обладают свойствами непредельных соединений. Основной продукт разложения каучука — изопрен.
В небольшой колбочке с отводной трубкой нагревают немного каучука.
Образующиеся парообразные продукты отводят в пробирку, охлаждаемую в стакане с водой, где они конденсируются. По образованию жидкости и газообразных веществ делают заключение об образовании из высокомолекулярного (твердого) продукта веществ с меньшей молекулярной массой. К собранному небольшому количеству жидкости приливают бромную воду или раствор перманганата калия и энергично встряхивают. Обесцвечивание раствора
указывает на непредельный характер образующихся при разложении каучука продуктов.
Опыты с резиновым клеем. Резиновый клей представляет собой раствор каучука в бензине. Поэтому с ним можно провести ряд опытов, характерных для каучука.
Каплю брома растворяют в 1 мл бензина или бензола и прибавляют 1 мл резинового клея. Исчезновение окраски указывает на непредельный характер каучука. Встряхивают 0,5 мл клея с раствором перманганата калия, наблюдают аналогичный результат.
Немного резинового клея наливают на стеклянную пластинку, выпаривают растворитель на водяной бане, остается тонкая пленка каучука. Снимают каучук со стекла и испытывают его эластичность, размягчение при нагревании (сравнивают отсутствие этого свойства у резины), растворимость в органических растворителях и нерастворимость в воде.
Открытие серы в вулканизированном каучуке. При сильном нагревании вулканизированного каучука сера выделяется из него в виде сероводорода и может быть обнаружена солями свинца:
Pb(NO3)2 + H2S à PbS + 2HNO,
В колбочке или пробирке нагревают несколько кусочков резины. В выделяющиеся пары вносят бумажку, смоченную раствором нитрата или ацетата свинца. Бумажка чернеет вследствие образования сульфида свинца.
Продукты термического разложения резины можно пропустить также в раствор соли свинца. Образуется черный осадок сульфида PbS.
Невулканизированный каучук (если он не загрязнен) в подобных условиях не образует осадка сульфида свинца.
Извлечение каучука из млечного сока растений. Каучук содержится в соке ряда растений и сравнительно легко может быть извлечен из них. Одним из каучуконосов является знакомое нам комнатное растение фикус. Понятно, что для получения каучука в промышленных целях подобные каучуконосы непригодны.
Для извлечения каучука из фикуса срезают один-два листа и собирают в пробирку выделяющийся из черешков млечный сок. К собранным каплям сока приливают немного воды и вносят 0,5 г хлорида кальция или сульфата аммония. Смесь встряхивают. Затем по каплям добавляют спирт, пока каучук не начнет выделяться на поверхности раствора.
1. Переносят хлопья каучука стеклянной палочкой в пробирку с 2—3 мл растворителя (бензола, бензина, хлороформа).
К части раствора приливают бромную воду или раствор перман-
ганата калия. Исчезновение окраски указывает на непредельный характер каучука.
Другую часть раствора осторожно выпаривают на часовом стекле. После удаления растворителя обнаруживается эластичная пленка каучука.
2. Хлопья каучука, извлеченные из раствора стеклянной палочкой, растягивают при помощи пинцетов. Образуются тонкие длинные нити каучука.
ГЛАВА III
АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ
Свойства ароматических углеводородов подробно изучаются на примере бензола. Из гомологов бензола опыты могут быть поставлены только с толуолом с целью показать общие свойства гомологов с бензолом и особенные свойства, обусловленные наличием боковой цепи. Изучение углеводородов с конденсированными ядрами не предусматривается программой.
БЕНЗОЛ
Ознакомление с физическими свойствами бензола, в том числе с растворимостью и растворяющим действием, малодоступно при постановке опытов на демонстрационном столе. Соответствующие опыты можно поставить в виде лабораторной работы или вынести на практические занятия учащихся.
Растворимость бензола. В три пробирки наливают по 1-2 мл воды, спирта и эфира. К жидкостям добавляют по равному числу капель бензола. Пробирки встряхивают и ставят рядом в штатив. Убеждаются, в каких жидкостях бензол растворяется.
Бензол как растворитель. В одну пробирку наливают 1 мл бензола, в другую — столько же воды. В пробирки помещают по маленькому кусочку жира или по несколько капель растительного масла. Пробирки взбалтывают. Наблюдают растворение жира в бензоле. На лист фильтровальной бумаги наносят каплю чистого бензола и рядом — каплю раствора жира в бензоле. Бензол испаряется полностью, от капли раствора остается жирное пятно.
На основании полученных результатов акцентируется внимание учащихся на том, что подобное растворяется в подобном.
Температура замерзания бензола. В демонстрационном опыте может быть показано, что бензол замерзает при температуре выше 0°С. Более точное определение температуры замерзания может быть вынесено на практические занятия. Там этот опыт будет служить цели практического ознакомления учащихся с методикой определения констант вещества.
В чашку с холодной водой и плавающими льдинками (или снегом) опускают одновременно две пробирки. В одной пробирке содержится 5 мл безводного бензола, в другой — такое же количество воды. Количество льда в воде должно быть достаточным, чтобы он не растаял полностью, так как охлаждающая смесь должна иметь температуру около 0°С. Когда учитель заметит, что бензол кристаллизуется, он достает пробирки из воды и показывает учащимся: бензол «застыл», вода осталась жидкой.
Для этого опыта не следует брать малые количества бензола (с целью его экономии). Различие в замерзании веществ лучше улавливается при указанных выше количествах; никакой потери бензола здесь не происходит: он быстро снова расплавляется и может быть использован для следующих опытов.
Горение бензола. Сжигание бензола в чашечке всегда дает много копоти. Опыт проходит достаточно наглядно, если в бензоле смочить кусочек фильтровальной бумаги и, взяв его щипцами, поджечь. Чтобы учащиеся не могли сказать, будто характер пламени и образование копоти обусловлены горением самой бумаги, необходимо вслед за тем или одновременно сжечь кусочек бумаги без бензола. Учащимся уже известны причины образования копоти при сгорании органических веществ. Учитель предлагает им самим объяснить наблюдаемое явление.
Отношение бензола к бромной воде и раствору перманганата калия. Эти опыты обычно ставятся в классе в связи с обоснованием структурной формулы бензола. Исходя из молекулярной формулы С6Н6, учащиеся делают вывод о непредельности бензола, и по аналогии с ранее изученным могут предположить, что он должен обесцвечивать бромную воду и раствор перманганата.
В пробирку наливают 1-2 мл бензола и затем немного бромной воды. Смесь взбалтывают. Обесцвечивания не происходит. Бром переходит в верхний слой бензола и окрашивает его. Параллельно следует показать в пробирке бромную воду.
Таким же образом демонстрируют опыт с раствором перманганата калия. Обесцвечивания раствора не происходит даже при нагревании. Констатируют отсутствие у бензола реакций, характерных для непредельных углеводородов: в аналогичных условиях бензол не присоединяет бром и не окисляется.
От раствора перманганата калия бензол можно отделить с помощью делительной воронки.
Бромирование бензола. Установив, что бензол не дает обычных реакций непредельных углеводородов, некоторые учителя переходят к опытам бромирования и нитрования бензола, чтобы показать аналогию со свойствами предельных углеводородов (замещение атомов водорода), и далее — к вопросу о строении бензола.
При обосновании структурной формулы бензола мы рекомендуем ограничиться лишь указанными выше «отрицательными» опытами, опыты же бромирования и нитрования ставить при изучении химических свойств бензола.
Это вызывается тем, что дважды демонстрировать сложные опыты учитель вряд ли будет, а без них изучение химических свойств сильно обедняется. Не случайно, что иногда специальное рассмотрение химических свойств бензола опускается вовсе, и в результате учащиеся, хорошо отвечая на вопрос о выводе структурной формулы бензола, затрудняются охарактеризовать химические свойства этого вещества.
Вместе с тем рассуждения о том, что бензол вступает в реакции, аналогичные предельным углеводородам, ничего по существу не дают для вывода его структурной формулы. Замечание же об отсутствии изомеров у монозамещенного бензола можно привести впоследствии как подтверждение структурной формулы.
Исходя из всего этого, после установления отрицательного результата с реактивами на непредельные соединения, целесообразно перейти к разбору реакции тримеризации ацетилена и на основе этого дать вывод структурной формулы.
При изучении химических свойств бензола учитель указваает, что, несмотря па наличие двойных связей, для бензола более характерны реакции замещения водорода, чем присоединения других атомов, и в качестве первого примера демонстрирует опыт бромирования бензола.
Реакция бензола с бромом, выражаемая уравнением:
С6Н6 + Вг2à С6Н5Вг + НВг
идет с чистым бромом и в присутствии катализаторов — бромида алюминия или железа. Так как бром легко взаимодействует с алюминием и железом, то для реакции можно брать металлические опилки (например, железные), и тогда катализатор образуется непосредственно о реагирующей смеси. Мелким порошком металла для опыта воспользоваться нельзя, так как реакция может пойти слишком бурно.
При получении больших количеств бромбензола бром необхо-
димо постепенно, по мере прохождения реакции, прибавлять к бензолу из капельной воронки, чтобы избежать слишком бурного течения процесса. Демонстрационный же опыт может быть поставлен с небольшими количествами вещества и поэтому в колбу можно помещать полностью заготовленные для опыта вещества.
Согласно уравнению реакции на 1 моль бензола требуется 1 моль брома, т.е. весовые соотношения веществ должны быть 78 : 160. Практически лучше брать бензола немного больше, чтобы бром полностью прореагировал.
Во избежание улетучивания паров брома и бензола опыт следует вести с обратным холодильником, можно воздушным.
 В колбу емкостью 100 мл (рис. 15) наливают 2 мл бензола и 1 мл брома. Отмечают, что реакция между веществами не происходит. Затем бросают в колбу очень немного (на кончике ножа) железных опилок и быстро закрывают колбу пробкой с вертикальной трубкой-холодильником, второй конец которой соединен с нисходящей трубкой, оканчивающейся воронкой над водой в стакане (вода служит для поглощения образующегося бромистого водорода). Обычно вскоре начинается реакция бензола с бромом, и, если она пойдет слишком бурно, колбу охлаждают, погружая ее в чашку с холодной водой. Если реакция долго не начинается, колбу слегка подогревают. Под конец опыта колбу также следует подогреть (горячей водой), чтобы реакция прошла до конца.
В колбу емкостью 100 мл (рис. 15) наливают 2 мл бензола и 1 мл брома. Отмечают, что реакция между веществами не происходит. Затем бросают в колбу очень немного (на кончике ножа) железных опилок и быстро закрывают колбу пробкой с вертикальной трубкой-холодильником, второй конец которой соединен с нисходящей трубкой, оканчивающейся воронкой над водой в стакане (вода служит для поглощения образующегося бромистого водорода). Обычно вскоре начинается реакция бензола с бромом, и, если она пойдет слишком бурно, колбу охлаждают, погружая ее в чашку с холодной водой. Если реакция долго не начинается, колбу слегка подогревают. Под конец опыта колбу также следует подогреть (горячей водой), чтобы реакция прошла до конца.
О ходе реакции учащиеся судят по изменениям в колбе и по образованию кислоты в стакане. Для этой цели в стакан с водой предварительно можно добавить раствор лакмуса или метилоранжа. Изменения в окраске раствора хорошо наблюдаются на фоне белого экрана. Если удалить стакан с водой и к концу трубки поднести палочку, смоченную аммиаком, то можно показать образование дыма бромида аммония. Пары бромистого водорода можно также пропускать в слабый раствор нитрата серебра; при этом наблюдается образование осадка бромида серебра.
После того как обнаружено образование паров бромистого во-
дорода, можно поручить наблюдение за реакцией лаборанту или одному из учащихся и перейти к проверке понимания учащимися опыта и соответствующего химического уравнения.
После окончания опыта жидкость из колбы выливают в стакан с водой и демонстрируют образовавшуюся тяжелую жидкость — бромбензол. Извлечение чистого бромбензола (удаление остатков бензола и образовавшихся частично о- и n-дибромбензолов) можно передать в химический кружок.
Для очистки реакционную смесь промывают в делительной воронке слабым раствором щелочи, затем водой, сушат хлоридом кальция и перегоняют из небольшой колбочки с воздушным холодильником. Отдельно собирают фракцию, кипящую в пределах 150—158°С (бромбензол кипит при температуре 155°С).
Нитрование бензола. Нитрование бензола может быть проведено с небольшими количествами исходных веществ, без выделения чистого продукта.
Для получения нитробензола по уравнению:
С6Н6 + HNO3 à C6H5NO2 + Н2О
<
Дата добавления: 2018-11-26; просмотров: 2175;











