АЦЕТОН (ДИМЕТИЛПРОПАНОН)
Школьной программой не предусматривается изучение кетонов. Однако некоторые учителя знакомят учащихся на уроках или в процессе внеклассной работы с окислением вторичных спиртов и практически наиболее важным представителем класса кетонов — ацетоном. Ниже приводятся опыты, которые могут быть использованы с этой целью.
Горение ацетона. Несколько капель ацетона наливают на крышку фарфорового тигля и поджигают. Ацетон горит слабо светящимся пламенем.
Растворимость ацетона в воде. К 2 мл воды добавляют равный объем ацетона. По встряхивании не удается установить расслоения жидкостей. Ацетон растворяется в воде.
Ацетон как растворитель смол и пластмасс. На этом свойстве ацетона основано его применение для изготовления лаков и для склеивания изделий из пластмасс.
а) В нескольких миллилитрах ацетона в пробирке растворяют при помешивании стеклянной палочкой столько целлулоида, чтобы раствор стал слегка вязким. Смачивают полученным лаком вату и натирают ею гладкий кусочек дерева — после улетучивания растворителя предмет оказывается «лакированным».
б) Два кусочка очищенной кинопленки или органического стекла (плексигласа) смачивают с концов ацетоном.
Через 1—2 мин накладывают концы пленки друг на друга и слегка сдавливают. После высыхания кусочки оказывают прочно склеенными ацетоном.
Отношение к аммиачному раствору оксида серебра. В две пробирки наливают одинаковые количества аммиачного раствора оксида серебра. В одну пробирку прибавляют раствор альдегида, в другую — такой же объем ацетона. Пробирки помещают одновременно в стакан с горячей водой. В пробирке с альдегидом появляется зеркало в пробирке с ацетоном восстановления серебра и, следовательно, окисления кетона не происходит.
Окисление ацетона. Ацетон не может быть окислен окисью серебра (см. предыдущий опыт), но он может быть окислен более энергичными окислителями.
Около 1 мл ацетона разбавляют в пробирке водой, приливают
серной кислоты, подогревают и вносят небольшими порциями измельченный перманганат калия, пока не перестанет исчезать его фиолетовая окраска. При нагревании раствора можно обнаружить по запаху пары уксусной кислоты.
При окислении происходит разрыв углеродной цепи и образование двух кислот — уксусной и муравьиной:
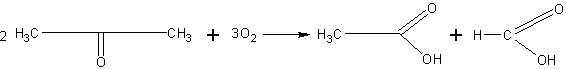
Получение бромацетона. Учащимся можно показать, что углеводородные радикалы кислородсодержащих органических веществ сохраняют в основном свойства углеводородов. Примером тому оказывается реакция бромирования ацетона:
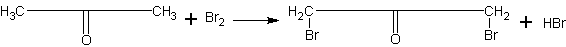
Реакция ацетона с бромом, кроме того, дает возможность довольно просто и в безопасной форме ознакомить учащихся с получением одного из слезоточивых веществ (лакриматоров). В настоящее время известны вещества, значительно превосходящие бромацетон по слезоточивому действию. Однако, принимая во внимание, что задача сводится к ознакомлению не с силой, а с характером действия вещества, целесообразно ограничиваться в указанных целях именно этим примером.
В вытяжном шкафу наливают в пробирку 1 мл ацетона и вносят несколько капель брома. Уже без подогрева обычно начинает ощущаться острый запах бромацетона. Если реакция не наступает, пробирку слегка подогревают (осторожно, беречь глаза!). Смачивают жидкостью из пробирки несколько полосок фильтровальной бумаги и раздают их на стеклышках учащимся или же помещают несколько капель жидкости на железную пластинку и нагревают ее над пламенем спиртовки.
Как только действие бромацетона на глаза обнаружено, хотя бы и в слабой форме, демонстрацию его прекращают и проветривают помещение.
Уравнение реакции учащиеся смогут составить сами, если им указать, что здесь в каждой молекуле ацетона замещается бромом один атом водорода.
В качестве наиболее сильного слезоточивого вещества указывается хлорацетофенон
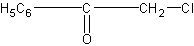
раздражающей концентрацией которого в воздухе считается 0,0003 мг/л.
Получение ацетона. В случае отсутствия в школьной лаборатории ацетон может быть получен для демонстрационных целей из солей уксусной кислоты, например, по реакции:
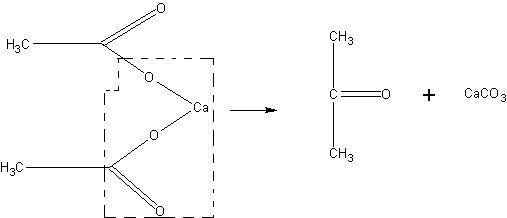
В наиболее простом виде опыт может быть проведен без выделения образующегося продукта.
В пробирке накаливают 2—3 г безводного ацетата натрия CH3COONa. Через 3—5 мин ощущается запах ацетона. Пары его при поджигании горят. По охлаждении пробирки с помощью соляной кислоты можно констатировать образование карбоната:
2CH3COONa à СН3 - СО - СН3 + Na2CO3
Na2CO3 + 2НС! à 2NaCl + Н2О + СО2
ГЛАВА VII
КАРБОНОВЫЕКИСЛОТЫ
Изучение предельных одноосновных кислот лучше всего начинать со второго члена гомологического ряда — с уксусной кислоты. Эта кислота частично уже известна учащимся, она доступна для школы, на ней более характерно проявляется структура карбоновых кислот. Муравьиная кислота как первый член ряда имеет некоторые особенности в строении и свойствах, а поэтому менее удобна для первоначального ознакомления с классом кислот.
В ряду одноосновных кислот вслед за уксусной и муравьиной рекомендуется рассмотреть также высшие гомологи кислот. Это позволит создать у учащихся более полную картину о гомологическом ряде и не возвращаться к этим кислотам в последующей теме при изучении жиров.
Химические свойства кислот в настоящей главе приводятся не полностью. С целью избежать повторения реакции кислот со спиртами описываются в следующей главе, где они являются специальным предметом рассмотрения.
УКСУСНАЯ КИСЛОТА
Учащимся знаком запах уксусной кислоты, они имеют представление о некоторых химических свойствах ее, поскольку эти свойства являются общими со свойствами неорганических кислот, знают структурную формулу кислоты. Поэтому не особенно существенно, какой порядок ознакомления с веществом будет принят. Если учитель сочтет необходимым уделить внимание обоснованию структурной формулы кислоты, то после рассмотрения физических свойств можно перейти к химическим свойствам, так как именно они дадут ответ на интересующий вопрос, и лишь затем рассмотреть способы получения.
Напротив, если учитель хочет подчеркнуть генетическую связь между органическими веществами различных классов, он предпочтет сначала рассмотреть способы получения кислот, особенно путем окисления спиртов и альдегидов, а затем перейдет к изучению химических свойств.
Кристаллизация уксусной кислоты. В демонстрационном опыте трудно показать, что чистая уксусная кислота кристаллизуется при + 16,7°С. Легче показать лишь сам факт «замерзания» ее при охлаждении. Наблюдение кристаллов объяснит учащимся, почему чистая уксусная кислота носит название ледяной.
1. В пробирку наливают несколько миллилитров уксусной кислоты (по возможности безводной) и помещают пробирку в ледяную воду. Вскоре при встряхивании наблюдают образование крупных блестящих кристаллов кислоты, напоминающих замерзшую воду. Если кислота не безводна, то она может не закристаллизоваться, в таком случае лучше пользоваться охладительной смесью снега с поваренной солью.
2. Вымораживанием кислоты из водного раствора легко получить чистую ледяную уксусную кислоту, которую можно хранить в качестве демонстрационного препарата. В небольшую колбочку наливают концентрированную уксусную кислоту и охлаждают в смеси снега с солью. Когда значительная часть жидкости закристаллизуется, выливают из колбы остаток жидкости — воду с некоторым количеством уксусной кислоты. Дают растаять замерзшей кислоте и снова помещают колбу в охладительную смесь. Когда часть жидкости снова закристаллизуется, опять сливают жидкость с кристаллов и повто-
ряют всю операцию еще раз. Так удается получить практически безводную уксусную кислоту, которую при понижении температуры очень легко переводить в кристаллическое состояние.
Горение уксусной кислоты. Проводя ряд аналогий между уксусной кислотой и минеральными кислотами, следует всякий раз подчеркивать особенность уксусной кислоты как кислоты органической, например ее горючесть.
Наливают в пробирку немного уксусной кислоты и нагревают в пламени горелки. При 118°С кислота кипит. Продолжая нагревание, поджигают пары лучинкой. Они горят слабо светящим пламенем. Учащиеся составляют уравнение реакции горения (в продуктах горения углекислый раз и вода) и дают объяснение слабой светимости пламени.
Отношение уксусной кислоты к окислителям. Легко показать, что, в отличие от спиртов и особенно альдегидов, уксусная кислота более устойчива по отношению к окислителям.
К разбавленному водному раствору чистой уксусной кислоты в химическом стакане прибавляют раствор перманганата калия и серной кислоты. Фиолетовая окраска раствора не исчезает.
Однако было бы неверным сделать заключение о неокисляемо-сти уксусной кислоты. Учащиеся уже знакомы с полным окислением кислоты при горении.
Действие уксусной кислоты на индикаторы. К растворам лакмуса и метилоранжа в демонстрационных пробирках или стаканчиках приливают немного раствора уксусной кислоты. Лакмус краснеет, метилоранж принимает розовую окраску (белый экран!).
Взаимодействие кислоты с металлами. В три пробирки наливают равные количества раствора уксусной кислоты. В одну пробирку помещают стружки магния, в другую — мелкие кусочки цинка, в третью — кусочки железной или медной проволоки. В первой пробирке наблюдают довольно энергичную реакцию. Убеждаются в том, что выделяющийся газ — водород, для чего пробирку закрывают пробкой с вертикальной трубочкой, собирают газ в перевернутую пробирку и поджигают его. Во второй пробирке реакция идет медленно и требует подогрев. Реакция с медью не идет даже при сильном нагревании.
Взаимодействие с основаниями. К очень разбавленному раствору щелочи, подкрашенному фенолфталеином, добавляют понемногу раствор уксусной кислоты, пока не обесцветится фенолфталеин. Составляют уравнение соответствующей реакции.
Аналогичный опыт может быть показан с гидроксидом кальция, взмученным в воде. При добавлении уксусной кислоты раствор становится прозрачным (ацетат кальция растворим в воде).
Взаимодействие с солями. Для опыта следует воспользоваться солью кислоты более слабой, чем уксусная, чтобы показать течение реакции до конца и образование соли уксусной кислоты. Наиболее удобны для этой цели карбонаты.
В маленькую колбу с отводной трубкой помещают 1—2 г поташа, соды или толченого мела и приливают 4—5 мл раствора уксусной кислоты. Колбочку закрывают пробкой и отводную трубку погружают в стакан с известковой водой. Известковая вода мутится от углекислого газа. Немного получившегося раствора можно выпарить на часовом стекле, чтобы наблюдать образование соли уксусной кислоты.
Уксусная кислота — кислота слабая. Чтобы показать учащимся, что уксусная кислота имеет небольшую степень диссоциации и является кислотой слабой, необходимо наряду с демонстрацией обычного опыта электропроводности ее поставить опыты, позволяющие провести хотя бы качественное сравнение скорости реакций уксусной кислоты и минеральных кислот.
а) В три пробирки помещают кусочки цинка и приливают равные количества соляной, серной и уксусной кислот (одинаковой концентрации). Замечают, что с уксусной кислотой реакция идет очень плохо или идет только при нагревании.
б) В три демонстрационные пробирки насыпают равные количества карбоната меди и прибавляют равные количества растворов соляной, серной и уксусной кислот одинаковой концентрации. Замечают, что в последнем случае скорость реакции наименьшая.
в) Если учащиеся знакомы с гидролизом солей, то можно показать гидролиз ацетата натрия и ацетата железа.
Последний опыт одновременно знакомит учащихся с характерной цветной реакцией уксусной кислоты.
К разбавленному раствору ацетата натрия приливают несколько капель фенолфталеина, и раствор разливают в две пробирки. Раствор в одной пробирке нагревают. Незначительное вначале порозовение фенолфталеина становится совершенно отчетливым при нагревании, так как гидролиз при этом усиливается:
CH3COONa + Н2O ó СН3СООН + NaOH
Поскольку водный раствор соли имеет щелочную реакцию, значит, уксусная кислота — кислота слабая.
Разбавленный раствор уксусной кислоты в стакане нейтрализуют постепенно щелочью в присутствии фенолфталеина или берут ранее полученный продукт нейтрализации. К раствору прибавляют несколько капель раствора хлорида железа FeCl3. Наблюдается характерное темно-красное окрашивание вследствие образования
ацетата железа Fe (III). При кипячении раствора образуется обильный красно-бурый осадок основного ацетата железа Fe(OH)2CH3COO. Гидролиз в этом случае проходит в значительной степени, так как соль образована слабым основанием и сравнительно слабой кислотой.
Основность уксусной кислоты. Хотя учащимся известны молекулярная и структурная формулы кислоты, можно экспериментально показать, что уксусная кислота одноосновна. Тогда станет совершенно очевидным различие в свойствах атомов водорода в молекуле кислоты.
Одноосновность кислоты легко показать, демонстрируя реакцию нейтрализации с применением молярных растворов.
Молярные растворы можно приготовить, например, из расчета 4 г едкого натра в 100 мл раствора и 6 г уксусной кислоты в 100 мл раствора. Отмеряют в коническую колбочку 10 мл молярного раствора кислоты, добавляют 2—3 капли фенолфталеина и прибавляют постепенно молярный раствор щелочи из другой бюретки до тех пор, пока появляющаяся розовая окраска не будет исчезать при взбалтывании жидкости, т.е. на каждую молекулу кислоты потребовалась одна, а не две и не три молекулы щелочи. Это значит, что уксусная кислота одноосновна.
Количественное получение метана из солей уксусной кислоты. Соли уксусной кислоты при нагревании со щелочью образуют метан (с. 27). Количественное проведение опыта дает возможность сделать заключение о структурной формуле кислоты.
Исследование продуктов реакции и сопоставление количества вступившей в реакцию соли с количеством образующегося метана позволяют сделают заключение о том, что реакция выражается уравнением:
CH3COONa + NaOH à СН4 + Na2CO3
На основании этого ведутся рассуждения о возможной структуре соли и, следовательно, кислоты.
Собирают прибор, как показано на рис. 30. В небольшую колбу или пробирку (желательно из тугоплавкого стекла) помещают хорошо перемешанную смесь порошков свежеприготовленного безводного ацетата натрия и натронной извести в весовом отношении 1 : 4 (например, 2 и 8 г или 3 и 12 г). Избыток извести необходим, чтобы обеспечить полное использование соли. Двугорлую склянку-газометр заполняют насыщенным раствором поваренной соли. Прибор проверяют на герметичность.
Смесь нагревают на газовой горелке. Нагревание должно быть равномерным и достаточно интенсивным. После того как объем
метана перестанет увеличиваться, нагревание прекращают и дают пробирке остыть. Некоторое количество раствора хлорида натрия при этом переходит обратно в склянку. Установив уровни жидкости в стакане и склянке на одной линии, определяют объем газа в склянке или объем жидкости в стакане.
Отделив газометр от пробирки, можно вытеснить из него часть газа (поднимая стакан с водой) и подтвердить, что этот газ — метан. Вычислив количество вещества исходной соли и количество вещества образующегося метана (н.у.), делают вывод, что из одного моля ацетата натрия получается один моль метана. Получающиеся отклонения из-за неполноты протекания реакции и образования побочных продуктов незначительны и совершенно не дают повода сделать какое-либо другое заключение (например, о том, что из одного моля соли образуется два моля метана).
Чтобы установить природу твердого продукта реакции, в пробирку добавляют немного соляной кислоты, закрывают пробкой и отводную трубку погружают в известковую воду. По помутнению известковой воды устанавливают, что при реакции образовался карбонат. Очевидно, что это карбонат натрия.
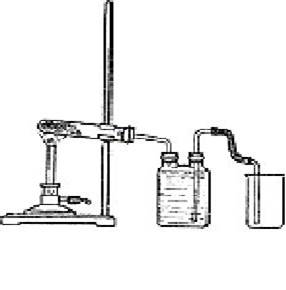
Рис. 30. Количественный опыт получения метана при взаимодействии ацетата натрия с натронной известью
Опыт дает надежные результаты в том случае, если исходные вещества будут тщательно подготовлены, хорошо перемешаны и будет обеспечено достаточное нагревание.
Получение кислоты окислением этанола. Альдегиды, как известно учащимся, легко окисляются в кислоты. Поэтому окисление спиртов в альдегиды можно поставить так, что образующийся альдегид, не успев удалиться из сферы реакции, тут же окислится далее в кислоту:
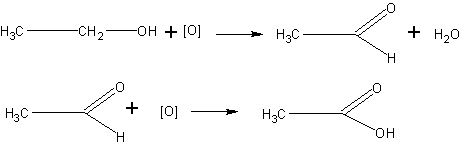
В качестве окислителя может быть использована хромовая смесь. Чтобы эта смесь могла окислить спирт в кислоту, реакцию проводят в условиях большей концентрации окислителя: берут больше бихромата, чем при получении альдегида, а спирт приливают к окислительной смеси постепенно, по мере отгонки образующейся кислоты.
Когда эти особенности получения кислоты обсуждены с учащимися, им становится понятным весь последующий опыт и одновременно закрепляются в памяти условия получения альдегидов из спиртов.
В колбочку с отводной трубкой (рис. 31) помещают 5 г измельченного бихромата калия К2Сг2О7 и 5 мл концентрированной серной кислоты. Из капельной воронки прибавляют по каплям водный раствор этанола (2 мл спирта на 8 мл воды) и отгоняют образующуюся уксусную кислоту. В приемнике собирается несколько миллилитров водного раствора уксусной кислоты с примесью альдегида и сложного эфира. Учащиеся должны дать объяснение изменению окраски раствора в колбе.

По запаху убеждаются в получении кислоты. Наблюдают образование водорода при действии на кислоту магния. Если учащиеся были знакомы также с цветной реакцией уксусной кислоты, то
нейтрализуют часть дистиллята содой (реакция не должна быть кислой) и добавляют несколько капель раствора хлорида железа (III). Темно-красное окрашивание раствора свидетельствует о наличии уксусной кислоты.
Запах уксусной кислоты иногда перебивается запахом альдегида. Чтобы освободиться от альдегида, кислоту нейтрализуют содой и раствор выпаривают. Альдегид при этом улетучивается. К остатку приливают минеральную кислоту и смесь слегка нагревают. Ощущается характерный запах уксусной кислоты.
Получение уксусной кислоты из ее солей. Данный эксперимент является повторением хорошо известного учащимся опыта из курса неорганической химии.
В колбочку с отводной трубкой насыпают 5 г обезвоженного ацетата натрия и добавляют 5 мл концентрированной серной кислоты. Сразу же начинается реакция. Подогревая колбу на горелке, отгоняют уксусную кислоту в пробирку через воздушный холодильник (стеклянную трубку). Если пробирку держать в ледяной воде, можно получить чистую уксусную кислоту в кристаллическом виде.
При необходимости уксусная кислота может быть получена таким способом' в значительных количествах.
Получение кислоты из продуктов сухой перегонки дерева. Ранее было показано (с. 86), что сухая перегонка дерева приводит к выделению дегтярной воды. Поэтому задача получения уксусной кислоты сводится к тому, чтобы удалить из дегтярной воды метанол и ацетон.
Предварительно с помощью лакмуса необходимо убедиться в присутствии кислоты в дегтярной воде.
Имеющееся в распоряжении количество дегтярной воды обрабатывают взмученной в воде известью до появления щелочной реакции на лакмус. При этом уксусная кислота образует ацетат кальция (СН3СОО)2Са. От раствора отгоняют метанол и ацетон или же раствор выпаривают до образования сухого остатка — так называемого древесного порошка, представляющего собой ацетат кальция с избытком извести. Порошок обрабатывают в колбе концентрированной серной кислотой и отгоняют уксусную кислоту, как в предыдущем опыте. В приемнике собирается концентрированная (60—80-процентная) уксусная кислота.
Получение уксусного ангидрида. Учащиеся должны иметь представление о том, что карбоновым кислотам, как и минеральным кислородсодержащим кислотам, соответствуют ангидриды.
При отсутствии в школьной лаборатории уксусного ангидрида (СН3СО)2О для демонстрационных целей он может быть приготовлен по реакции ацетата натрия с хлористым ацетилом:
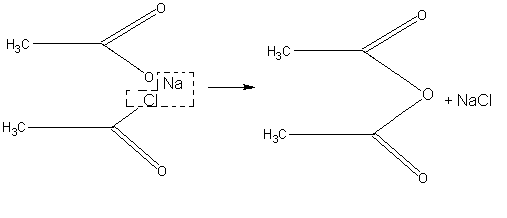
Чтобы жидкий хлористый ацетил по возможности нацело прореагировал и не улетучивался с ангидридом, пользуются избытком нелетучего вещества — ацетата натрия. Опыт проводят в вытяжном шкафу.
В колбу с отводной трубкой помещают 8 г обезвоженного ацетата натрия и приливают маленькими порциями 4—5 мл хлористого ацетила, встряхивая при этом колбу. Реакция образования ангидрида идет с выделением тепла.
К колбе присоединяют воздушный холодильник и отгоняют образующийся ангидрид на пламени горелки (темп. кип. 140°С). Сперва колбу нагревают осторожно, затем нагревание усиливают. Так как ангидрид обычно получается все же с примесью хлористого ацетила, к дистилляту прибавляют 0,5—1 г порошка ацетата натрия, чтобы полностью превратить хлористый ацетил в ангидрид, и снова перегоняют или же сохраняют его с примесью этой соли. Препарат обладает запахом уксусной кислоты. Хранят его в плотно закупоренной склянке. При действии воды на уксусный ангидрид образуется уксусная кислота:
(СН3СО)2O + Н2О à 2СН3СООН
О наличии последней убедительно свидетельствует лакмусовая бумажка.
Получение хлористого ацетила. Хлористый ацетил может оказаться необходимым не только для получения ангидрида уксусной кислоты, но и для синтеза сложных эфиров.
Его получают действием треххлористого фосфора на уксусную
кислоту:
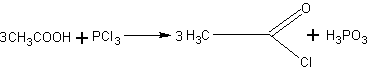
В колбу, соединенную с нисходящим водяным холодильником, помещают ледяную уксусную кислоту и при охлаждении небольшими порциями прибавляют треххлористый фосфор. Затем колбу закрывают пробкой и нагревают в вытяжном шкафу на водяной бане при 45— 50°С. Нагревание ведут до тех пор, пока не прекратится выделение хлороводорода (вследствие взаимодействия трех-
хлористого фосфора с протонсодержащими реагентами) и пока жидкость не разделится на два слоя. Сверху собирается хлористый ацетил, а внизу — фосфористая кислота. Хлористый ацетил отгоняют на водяной бане.
Так как хлористый ацетил чрезвычайно легко разлагается влагой воздуха, то приемник следует закрыть хлоркальциевой трубочкой.
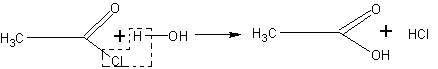
Хлористый ацетил можно отделить от фосфористой кислоты также с помощью делительной воронки.
Непременным условием успеха опыта является использование совершенно сухой посуды. Хранят хлористый ацетил в сухой склянке с плотной пробкой, залитой парафином.
Реакция хлористого ацетила с водой может служить наглядным примером взаимного влияния атомов в молекуле. Чрезвычайная подвижность атома хлора в группировке
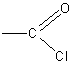
объясняется смещением электронной плотности в сторону кислорода карбонильной группы.
К 5—6 мл холодной воды в пробирке прибавляют несколько капель хлористого ацетила. Хлористый ацетил энергично реагирует с водой, образуя уксусную и соляную кислоты. В этом легко убедиться с помощью лакмуса и раствора нитрата серебра. Если вода для опыта взята недостаточно холодная, реакция происходит мгновенно. Разумеется, никакого подогрева смеси при этом не производится. Уксусный ангидрид реагирует с водой значительно слабее.
Исследование образца уксусной кислоты. Работа представляет интерес для внеклассных занятий по химии, так как знакомит учащихся с приемами контроля химической продукции.
Уксусная кислота может быть различной концентрации и может содержать примесь минеральных кислот, спирта и других органических веществ. Зная способ получения кислоты, учащиеся могут объяснить, как появляются эти примеси.
Концентрацию уксусной кислоты определяют титрованием ее щелочью известной концентрации. Для титрования столового уксуса может быть приготовлен 0,1 М раствор щелочи, для титрования эссенции — молярный раствор. С помощью бюретки берут по
5 мл исследуемого раствора в три конические колбочки, добавляют по 2—3 капли фенолфталеина и титруют из бюретки щелочью до появления остающейся при взбалтывании розовой окраски фенолфталеина. Из трех определений берут среднее арифметическое. Зная, что реакция выражается уравнением
СН3СООН + NaOH à CH3COONa + Н2О
вычисляют молярную, а затем и процентную концентрацию кислоты в исследуемом образце.
Примесь серной кислоты определяют, добавляя к образцу раствор хлорида бария. При отсутствии серной кислоты не должно получаться мути сульфата бария.
Примесь соляной кислоты устанавливают с помощью раствора нитрата серебра. В случае наличия хотя бы незначительного количества соляной кислоты при добавлении раствора нитрата серебра и подкислении азотной кислотой появляется муть или осадок.
Примесь органических соединений устанавливается с помощью слабого (0,1%) раствора перманганата калия. При наличии примесей перманганат обесцвечивается; уксусная кислота в этих условиях, как известно, не окисляется.
Таким способом могут быть исследованы образцы химически чистой уксусной кислоты, столового уксуса, уксусной эссенции и кислоты, полученной учащимися в лаборатории.
МУРАВЬИНАЯ КИСЛОТА
При изучении муравьиной кислоты необходимо поставить опыты, показывающие особенности ее строения и химических свойств.
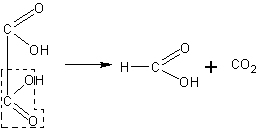
Разложение муравьиной кислоты на оксид углерода (II) и воду. После того как учащиеся ознакомятся с физическими свойствами муравьиной кислоты (агрегатное состояние, запах, цвет) и вспомнят ее структурную формулу по реакциям окисления формальдегида, целесообразно поставить вопрос о том, как может быть подтверждена ее структурная формула. Учащиеся обращают внимание на то, что молекула муравьиной кислоты построена как бы из молекулы воды и молекулы оксида углерода (II):

Естественно встает вопрос, нельзя ли получить кислоту реакцией оксида углерода (II) с водой. Учитель сообщает, что эта реак-
ция не идет так просто, как кажется: угарный газ не вступает в реакцию с водой. Но можно провести обратную реакцию: разложить кислоту на оксид углерода (II) и воду. В качестве водоотнимающего средства можно воспользоваться часто применяемой для этой цели серной кислотой. Оксид углерода (II) нетрудно будет обнаружить по его характерному пламени при горении.
В небольшую колбочку (или пробирку) с отводной трубкой наливают 1 мл муравьиной кислоты и 3-4 мл концентрированной серной кислоты. Колбу закрывают пробкой и нагревают в пламени горелки. Образующийся газ собирают в два цилиндра над водой. Во втором цилиндре газ поджигают (в первом — смесь газа с воздухом может дать взрыв). По синей окраске пламени учащиеся узнают оксид углерода (II). После этого поджигают оксид углерода (II) у отводной трубки. Опыт ведут до полного разложения муравьиной кислоты или останавливают его, прекращая нагревание. При проведении опыта необходимо следить, чтобы ядовитый газ не проникал в помещение. Опыт подтверждает формулу муравьиной кислоты.
Окисление муравьиной кислоты. Учащиеся легко устанавливают, что муравьиная кислота одновременно является альдегидом, так как имеет группировку атомов
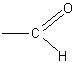
Это дает возможность предположить, что муравьиная кислота должна окисляться легче уксусной, и в частности давать реакцию серебряного зеркала.
До проведения опыта можно высказать предположение и о том, какие вещества будут получаться в результате реакции. Учащиеся составляют уравнение реакции, аналогичное уравнению для альдегидов, и замечают, что образуется угольная кислота:
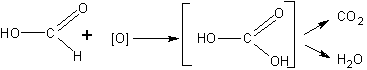
Поскольку угольная кислота, как известно, распадается с образованием углекислого газа, то для большей убедительности опыт, следовательно, надо поставить так, чтобы попытаться обнаружить углекислый газ.
а) Окисление перманганатом калия. В колбочке или пробирке с отводной трубкой к 1 мл муравьиной кислоты приливают 10 мл разбавленного раствора перманганата калия и немного серной кис-
лоты. Нагревают колбу через асбестовую сетку. Отводную трубку опускают в известковую воду. Перманганат калия при реакции обесцвечивается, содержимое колбы пенится от образующегося газа, и известковая вода мутится. Уксусная кислота, как известно, не обесцвечивает перманганат калия.
б). Окисление аммиачным раствором гидроксида серебра. Реакцию проводят как обычно, однако восстанавливающееся серебро при этом чаще всего выделяется не в виде зеркала, а в виде черного
осадка.
Получение муравьиной кислоты. Получение муравьиной кислоты из спирта и альдегида после всего изученного не представляет особого интереса. Значительно важнее было бы показать учащимся получение кислоты синтезом формиата натрия из оксида углерода(II) и едкого натра, что соответствует промышленному способу. Однако необходимость обращения со значительными количествами оксида углерода (II), даже при всей тщательности работы, делает опыт неприемлемым для школы.
При отсутствии в лаборатории муравьиной кислоты она может быть приготовлена нагреванием щавелевой кислоты с глицерином. Щавелевая кислота в этих условиях разлагается, образуя углекислый газ и муравьиную кислоту:
В колбу емкостью 200—250 мл с отводной трубкой помещают 30 г безводного глицерина и 30 г безводной щавелевой кислоты (кислоту обезвоживают осторожным нагреванием в сушильном шкафу при 95 - 100°С). Закрывают колбу пробкой с термометром, шарик которого погружают в смесь веществ. К колбе присоединяют нисходящий холодильник и приемник для дистиллята. Нагревают колбу через асбестированную сетку так, чтобы термометр показывал 110 — 115°С. Около 100°С начинается обильное выделение углекислого газа. При этом начинает отгоняться муравьиная кислота. Когда выделение углекислого газа станет слабым, добавляют вторую порцию (30 г) щавелевой кислоты и снова продолжают перегонку. При необходимости добавляют третью такую же порцию кислоты. После повторной дистилляции удается получить довольно крепкую муравьиную кислоту (темп. кип. кислоты 100°С).
Если почему-либо не удалось приготовить безводную щавелевую кислоту, можно воспользоваться кристаллической кислотой, беря ее всякий раз несколько большее количество. В этом случае будет получаться менее концентрированная кислота, так как одновременно перегоняется значительное количество воды.
Взаимодействие формиата натрия с натронной известью. Учащимся известно, что при нагревании солей карбоновых кислот с натронной известью (или едким натром) образуются соответствующие углеводороды.
Будет очень интересно предложить учащимся решить вопрос о том, какие продукты получатся при нагревании формиата натрия с натронной известью, а затем поставить соответствующий опыт и определить образующиеся вещества.
При реакции получаются водород и карбонат натрия:
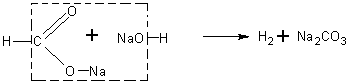
Дата добавления: 2018-11-26; просмотров: 4957;











