Кислотно-основные свойства органических соединений
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. ГИДРОКСИСОЕДИНЕНИЯ. СПИРТЫ. ФЕНОЛЫ
Кислотно-основные свойства органических соединений
Кислотность и основность – важнейшие понятия, определяющие многие физико-химические и биологические свойства органических соединений. Слабые кислоты и основания – обычные компоненты биологических систем, играющие важную роль в метаболизме и его регуляции. По теории электролитической диссоциации Аррениуса, кислота – это электролит, диссоциирующий с образованием ионов водорода и кислотного остатка. Основание – это электролит, диссоциирующий с образованием гидроксид-ионов. Эти положения справедливы для процессов, протекающих в водных растворах, но они не объясняют поведение веществ в неводных растворах. Исследование диссоциации веществ в неводных растворителях расширило представления о веществах, проявляющих кислотные и основные свойства.
В 1923 году Бренстедом и Лоури была предложена протонная (протолитическая) теория.
Основные положения протонной теории кислот и оснований:
1. Кислотами являются частицы (молекулы и ионы), способные отдавать протон в данной реакции.
2. Основаниями являются частицы, способные принимать протон в данной реакции. Частицы в целом называются протолитами.
3. Соотношения между кислотой и основанием выражаются схемой:
кислота ↔ H+ + основание
Частицы, отличающиеся по составу только наличием в одной и отсутствием в другой передаваемого протона, называется сопряженной парой протолитов
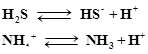 |
4. Чем активнее вещество отдает протон, тем более сильной кислотой оно является, чем сильнее связывает протон, тем более сильным основанием выступает вещество. Сильной сопряженной кислоте соответствует слабое сопряженное основание и наоборот.
НСI(сильн. кислота) ↔H++CI-(слаб. основание)
СH3СООН(слаб. кислота) ↔H++СН3СОО-(сильное основание)
5. Различают следующие кислоты-протолиты:
а) нейтральные Н2SO4 ↔ H++HSO4-
б) катионные NН4+ ↔ NH3 + H+
в) анионные HCОз - ↔ H++ СО32-
6) Выделяют особый класс веществ, способных как отдавать, так и принимать протон. Эти вещества называются амфолиты, например молекула воды:
Н2O (кислота) ↔ Н++ ОН-
H++ Н2O (основание) ↔ H3O+
Количественно кислотные свойства протолитов оцениваются значением константы кислотности протолита - Ка. Чем больше значение константы кислотности, тем сильнее кислота.
На практике чаше используют показатель кислотности протолита:
pКа= -lg Ка
Например: Ка(СН3СООН)=1,75·10-5
рКа(СНзСООH)=- lg 1,75·10-5 = 4,75
Чем меньше значения рКа, тем сильнее кислота. Протонная теория позволила объяснить кислотно-основные свойства органических веществ. Согласно протонной теории кислот и оснований, большинство органических соединений можно рассматривать как кислоты, поскольку в их молекулах содержатся связи атома водорода с разными элементами (С, S, O, N). Органические кислоты соответственно классифицируются по кислотному центру на О-Н; S-H; N-H;C-H кислоты.
Кислотным центромназывается элемент и связанный с ним положительно поляризованный атом водорода.
Дата добавления: 2016-10-18; просмотров: 4134;











