Стабильность аниона за счёт сопряжения
Пример: сравнить кислотность двух соединений:
СН3–СН2–ОН (рКа=18), С6Н5–ОН (рКа=9,9).
Исходя из величин рКа, у фенола более выражены кислотные свойства. При объяснения этого факта следует учитывать влияние электронных эффектов заместителей в молекулах приведённых веществ, например, этанола СН3–СН2–ОН. -ОН (-I, ЭА). Под влиянием ЭА заместителя
ОН-группы в молекуле этанола электронная плотность смещается к заместителю и практически не делокализована по всей молекуле, а сосредоточена на атоме кислорода. Алкоксид-ион СН3–СН2–О- будет обладать низкой стабильностью и поэтому проявляет слабовыраженные кислотные свойства.
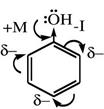
В молекуле фенола под влиянием ЭД заместителей электронная плотность смещена от заместителя и делокализована по ароматическому кольцу. ОН-группа (-I, +М; +М>>-I, ЭД). Образующийся при отщеплении иона водорода феноксид-ион, являясь сопряжённой системой, будет обладать более высокой стабильностью по сравнению с алкоксид-ионом, который не является сопряжённой системой. Поэтому фенол проявляет более выраженные кислотные свойства.

Влияние радикала на стабильность аниона
Пример: сравнить кислотность двух соединений:
СН3–СН2–СООН (рКа=4,9), СН3–СН(OH) –СООН (рКа=3,83).
Наличие в радикале этой кислоты ЭА заместителя –ОН-группы способствует делокализации отрицательного заряда в лактат-анионе, что повышает его стабильность по сравнению с пропионат-анионом, радикал которого не содержит такого заместителя. ЭА-заместители усиливают кислотность, а ЭД - снижают.
Дата добавления: 2016-10-18; просмотров: 3439;











