ТЕХНИКА И МЕТОДИКА ШКОЛЬНЫХ
ОПЫТОВ ПО ОРГАНИЧЕСКОЙ ХИМИИ
ГЛАВА I
ПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
Из предельных углеводородов в школе подробно изучается метан как вещество, наиболее простое по составу и строению, наиболее доступное для практического ознакомления и имеющее большое народнохозяйственное значение в качестве химического сырья и топлива.
Опыты с первым, изучаемым в органической химии веществом, должны быть поставлены в достаточном количестве и с особой тщательностью в методическом отношении, так как они должны показать новые стороны эксперимента при изучении органической химии. Здесь опытным путем можно будет установить состав и молекулярную формулу вещества, что является первой ступенью в определении структурных формул органических соединений.
МЕТАН.
Порядок опытов с метаном может быть различным. В основном он будет определяться тем, начнет ли учитель тему с получения метана и затем поставит опыты по изучению свойств его, пользуясь получаемым на уроке веществом, или же использует заранее заготовленный метан, чтобы четко выдержать последовательность изучения вопросов — вначале рассмотреть физические свойства вещества, затем химические свойства, применение вещества и, наконец, получение его. В последнем случае опыт получения метана будет поставлен лишь в конце темы.
Первый способ изучения темы и, следовательно, построения эксперимента более сложен в методическом отношении, но более экономен во времени. Второй способ потребует больше времени, но он методически более прост и к тому же ценен тем, что позволит в заключение повторить и закрепить знание основных опытов с веществом, когда оно будет получено на уроке.
При изучении метана нет особой необходимости в постановке лабораторных опытов. По существу они могли бы свестись здесь лишь к получению метана и сжиганию его. Но получение метана из ацетата натрия и горение его легко можно показать на демонстрационном столе.
Целесообразней будет после изучения всей темы «Углеводороды» поставить специальное практическое занятие. На этом занятии учащиеся воспроизведут опыт получения метана и смогут убедиться в том, что метан не обесцвечивает бромную воду и раствор перманганата калия.
Получение метана в лаборатории. Наиболее удобный лабораторный способ получения метана — взаимодействие ацетата натрия с натронной известью.
Взаимодействие солей карбоновых кислот со щелочью является общим способом получения углеводородов. Реакция в общем виде изображается уравнением:
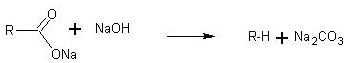
если R = СН3, то образуется метан.
Поскольку едкий натр является веществом гигроскопичным, а присутствие влаги мешает успешному прохождению реакции, то к нему добавляют оксид кальция. Смесь едкого натра с оксидом кальция и называется натронной известью.
Для успешного протекания реакции требуется довольно сильное нагревание, однако чрезмерный перегрев смеси ведет к побочным процессам и получению нежелательных продуктов, например ацетона:
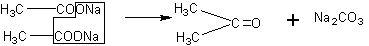
Ацетат натрия до опыта должен быть обезвожен. Натронную известь перед приготовлением смеси также следует прокалить. Если нет готовой натронной извести, ее готовят следующим образом. В железной или фарфоровой чашке обливают хорошо прокаленную измельченную известь СаО вдвое меньшим количеством насыщенного водного раствора щелочи NaOH. Смесь выпаривают досуха, прокаливают и измельчают. Вещества хранят в эксикаторе.
Для демонстрации получения метана лучше всего воспользоваться небольшой колбой с отводной трубкой, а для практического занятия — пробиркой (рис. 1 и 2).
Собирают прибор, как указано на рис. 1 или 2. В промывную
склянку, для улавливания примесей, наливают раствор щелочи (рис. I). В реакционную колбу или пробирку помещают смесь ацетата натрия и натронной извести. Для этого тонкоизмельченные вещества тщательно смешивают в объемном отношении 1:3, т.е. со значительным избытком извести, чтобы заставить по возможности полностью прореагировать ацетат натрия.
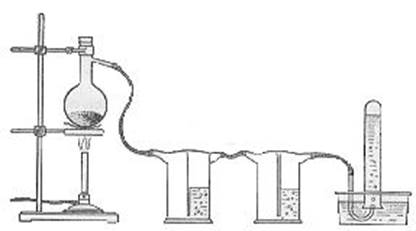
Рис. I. Получение метана в лаборатории (демонстрационный опыт)
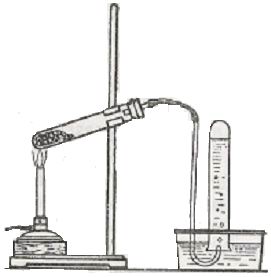
Колбу нагревают с помощью горелки через асбестовую сетку, а пробирку на голом пламени. Собирают метан в пробирку по способу вытеснения воды. Для проверки чистоты полученного газа пробирку вынимают из воды и не переворачивая поджигают газ.
Так как процесс получения метана нецелесообразно прерывать, а все другие опыты невозможно успеть выполнить, пока идет реакция, то рекомендуется набрать газ для последующих опытов в несколько цилиндров (пробирок) или в газометр.
Наполненные цилиндры оставляют на время в ванне или же закрывают под водой стеклянной пластинкой (пробкой) и ставят на стол вверх дном.
Метан легче воздуха. Для ознакомления с физическими свойствами метана учитель демонстрирует цилиндр с собранным газом. Учащиеся наблюдают, что метан — газ бесцветный. Собирание метана по способу вытеснения воды дает основание предположить, что этот газ, по-видимому, нерастворим в воде. Учитель подтверждает это заключение.
На весах уравновешивают две одинаковые колбы возможно большей емкости. Одна из колб подвешена вверх дном (рис. 3). В эту колбу пропускают некоторое время метан из прибора. Чашка весов поднимается вверх. Чтобы учащиеся не думали, будто изменение в весе происходит из-за давления струи газа на дно колбы, обращают внимание на то, что нарушение равновесия остается и после того, как прекращено пропускание метана.
После того как весы будут снова приведены в равновесие (для этого на некоторое время перевертывают вверх горловиной склянку с метаном), для сравнения и большей убедительности выводов пропускают метан в нормально стоящую на весах колбу. Равновесие весов не нарушается.
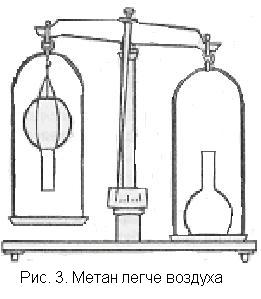
Показав, что метан легче воздуха, учитель сообщает, сколько весит при нормальных условиях литр метана. Эти сведения будут нужны далее при выводе молекулярной формулы вещества.
Горение метана. Вслед за рассмотрением физических свойств метана может быть поставлен вопрос о том, какова молекулярная формула метана. Учитель сообщает, что в целях выяснения этого вопроса нужно будет предварительно ознакомиться с одним из химических свойств метана — горением.
Горение метана может быть показано в двух вариантах.
1. Стеклянный цилиндр (емкостью, например, 250 мл), заполненный метаном, ставят на стол, снимают с него пластинку или открывают пробку и без промедления поджигают газ лучинкой. По мере сгорания метана пламя опускается 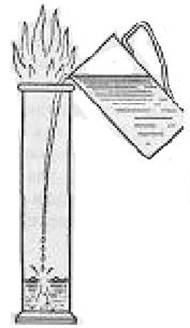 внутрь цилиндра.
внутрь цилиндра.
Чтобы пламя держалось все время над цилиндром и было хорошо заметно учащимся, в цилиндр с горящим метаном можно вливать постепенно воду, вытесняя тем самым газ наружу (рис. 4).
2. Поджигают метан непосредственно у отводной трубки прибора для получения газа или газометра (и в том и в другом случае обязательна проверка на чистоту!). Величину пламени регулируют интенсивностью нагрева в первом случае и высотой столба вытесняющей жидкости во втором случае. Если метан очищен от примесей, он горит почти бесцветным пламенем. Чтобы устранить некоторую светимость пламени (желтую окраску), обусловленную солями натрия, находящимися в стекле трубки, можно к концу трубки присоединить металлический наконечник.
Определение качественного состава метана. Горение метана выражается уравнением:
СН4 + 2О2 à СО2 + 2Н2О
Если при горении суметь обнаружить углекислый газ и воду, то по продуктам реакции можно будет сделать заключение о качественном составе метана. Образование углекислого газа свидетельствует о наличии углерода в метане, образование воды — о наличии водорода.
Такое заключение о составе метана не является достаточно строгим, так как здесь не проверяется, не получаются ли при этом еще другие продукты реакции и не находится ли кислород в составе метана. Однако опыт обычно с большим удовлетворением воспринимается учащимися, и выводы из него не вызывают сомнений. В случае вопросов со стороны учащихся может быть указано, что другие вещества не обнаружены в продуктах реакции и что точный количественный анализ подтверждает сделанный вывод о качественном составе.
Над пламенем горящего метана (у отводной трубки прибора, газометра или газовой горелки) держат повернутый вверх дном чистый и сухой химический стакан (рис. 5). Стенки стакана становятся влажными. Даже далеко сидящие учащиеся видят, что стакан «запотел». После этого споласкивают стакан известковой водой (лучше баритовой) и снова помещают над пламенем. На стенках стакана появляются белые пятна и полосы образующегося нерастворимого карбоната бария:
Ва(ОН)2 + СО2  à ВаСО3 + Н2О
à ВаСО3 + Н2О
После этого опыта можно перейти к выводу молекулярной формулы метана.
Один литр метана при нормальных условиях весит 0,174 г. Отсюда молекулярный вес метана М = 22,4 • 0,174 = 16.
Так как метан состоит из углерода и водорода, а атомный вес углерода равен 12, то, очевидно, в молекуле метана может содержаться только один углеродный атом. В таком случае в молекуле должны содержаться еще 4 атома водорода (16 — 12 = 4), что вполне согласуется с валентностью этих элементов.
Взрыв смеси метана с кислородом. В числе химических свойств, которые изучаются после обсуждения вопроса о молекулярной формуле метана, прежде всего отмечают известное уже свойство — горение метана. Сведения о реакции горения учитель дополняет сообщением о свойстве метана давать взрывчатые смеси с кислородом и с воздухом. Соотношение объемов газов для полного сгорания метана при взрыве учащиеся находят из приведенного выше уравнения (1 : 2 в случае взрыва с кислородом и 1 : 10 при взрыве с воздухом). Когда одно из веществ имеется в избытке против стехиометрических отношений (другое, следовательно, содержится в недостатке), образуется более слабый, взрыв, а при сильном расхождении взрыв и вовсе не образуется.
Толстостенный стеклянный сосуд или банку емкостью 200—250 мл градуируют в отношении 1 : 2 (делят на три равные по объему части). Для этого наполняют банку водой и определяют емкость ее, вылив воду в мерный цилиндр. Затем наливают в банку воду частями по 1/3 объема и каждый раз делают на стенке снаружи метку восковым карандашом или маркером.
По способу вытеснения воды наполняют банку на 2/3 объема кислородом и на 1/3 метаном. Банку закрывают под водой пробкой и, вынув из воды, несколько раз перевертывают для лучшего смешения газов. Этой цели хорошо помогает остающееся в банке очень небольшое количество воды.
Банку обертывают полотенцем на случай, если бы стекло оказалось непрочным и не выдержало взрыва. Отойдя в сторону от приборов, находящихся на столе, открывают пробку и, держа банку несколько наклонно вниз, поджигают смесь лучинкой. Происходит взрыв. Смесь нельзя поджигать спиртовкой, так как взрывной волной ее может опрокинуть.
Для взрыва метана с воздухом соответствующий сосуд градуируется на 11 частей (1 часть метана, 10 частей воздуха). Чтобы показать взрывоопасность природного газа и, следовательно, необходимость внимательного обращения с ним в лаборатории, на производстве и в быту, целесообразно для демонстрации этого опыта воспользоваться вместо метана природным газом.
Замещение в метане водорода хлором. Хлор, будучи смешан с метаном, на рассеянном свету постепенно атом за атомом замещает в метане водород, образуя хлорметан, затем дихлорметан, хлороформ и, наконец, четыреххлористый углерод:
CH4 + CI2 à CH3CI + HCI
CH3CI + CI2à CH2CI2 + HCI
CH2CI2+ CI2 à CH3CI + HCI
CHCI3 + CI2à CCI4 + HCI
В результате реакции образуется смесь продуктов.
Реакция идет длительное время, поэтому для демонстрации ее удобно воспользоваться двухчасовым занятием. Опыт ставят в начале первого урока и привлекают к нему внимание учащихся на втором уроке в связи с повторением и обобщением материала занятия. Можно опыт оставить до следующего дня занятий.
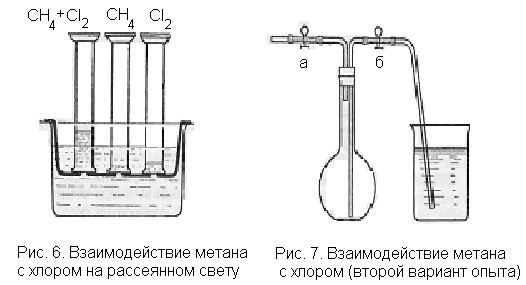
Опыт проводится в двух цилиндрах. Первый цилиндр с пришлифованными краями заполняют метаном по способу вытеснения воздуха. Второй такой же цилиндр заполняют хлором. Затем соединяют цилиндры отверстиями и перемешивают газы, переворачивая их вместе несколько раз. Цилиндры закрывают плотно пробками и один из них оставляют для наблюдения. В нем замечают ослабление окраски хлора вследствие реакции, а иногда и образование жидких веществ в виде маслянистых капель на стенках цилиндра. При открывании цилиндра появляется легкий туман, что подтверждает факт образования хлористого водорода в результате данной реакции.
Второй цилиндр со смесью метана и хлора опускают отверстием вниз в ванну с насыщенным раствором поваренной соли1. (Прибор не оставлять на прямом солнечном свету!) О течении реакции судят по уменьшению объема газовой смеси (уровень жидкости в цилиндре постепенно повышается), по ослаблению окраски хлора и по образованию маслянистых капелек на стенках цилиндра.
Чтобы маслянистые капли были отчетливо видны, цилиндр для смеси газов должен быть предварительно хорошо промыт и высушен.
Так как учащиеся иногда утверждают, что уровень жидкости повышается вследствие частичного растворения в воде метана и хлора, можно одновременно с цилиндром, содержащим смесь газов, погрузить в раствор поваренной соли цилиндр с метаном и цилиндр с хлором (рис. 6). Учащиеся в таком случае увидят, что уровень раствора в этих цилиндрах, в отличие от цилиндра со смесью газов, почти не повышается. Следовательно, метан и хлор в первом цилиндре тратятся на химическую реакцию между ними; образующийся при этой реакции газообразный продукт — хлористый водород — значительно лучше растворяется в воде, чем исходные газы.
Опыт можно также поставить, воспользовавшись вместо цилиндров демонстрационными пробирками.
Второй вариант демонстрационного эксперимента иллюстрирующего замещение атомов водорода на хлор в метане может быть осуществлен следующим образом.
Колбу емкостью около 1 л заполняют по способу вытеснения воды смесью метана и хлора (рис. 7). Для этого в нее пропускают вначале метан, затем примерно тройной объем хлора, пока вода полностью не будет вытеснена в стакан. После этого закрывают зажимы а и б и оставляют колбу стоять до тех пор, пока окраска хлора не исчезнет. Тогда открывают зажим б и наблюдают, как вода из стакана устремляется в колбу вследствие образовавшегося в ней разрежения. Если к этой воде предварительно добавить индикатор, то можно заметить изменение окраски под действием образовавшегося хлористого водорода.
Другие способы получения метана. При рассмотрении специального вопроса о способах получения метана в памяти учащихся восстанавливают сначала опыт получения его из ацетата натрия и натронной извести. Затем внимание учащихся обращают на образо-
вание метана в природе при разложении растительных и животных остатков (почему метан и сопутствует обычно нефти, каменному углю и даже торфу).
Образование метана при разложении клетчатки без доступа воздуха может быть выражено уравнением (уравнение дается не для учащихся):
(С6Н10O5)n + nН2О à ЗnСО2 + ЗnСН4
 В связи с обсуждением этого вопроса в порядке внеклассной работы может быть поставлено собирание метана на болоте и получение метана при разложении растений. Результаты работы могут быть продемонстрированы на уроке.
В связи с обсуждением этого вопроса в порядке внеклассной работы может быть поставлено собирание метана на болоте и получение метана при разложении растений. Результаты работы могут быть продемонстрированы на уроке.
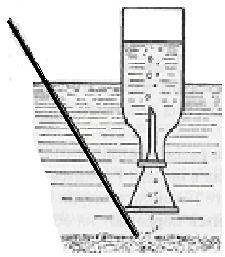
1. Для собирания метана выбирается неглубокий, сильно заболоченный водоем. Толстостенную склянку или бутылку погружают в воду, чтобы она заполнилась водой, затем повертывают ее вверх дном, вставляют воронку (рис. 8) и собирают метан, разрыхляя дно с помощью палки.
Когда в склянке соберется газ, ее закрывают под водой резиновой пробкой и после этого вынимают из воды. Склянка должна быть закрыта так, чтобы в нее не проник воздух, иначе при последующих опытах может произойти взрыв. Для вытеснения газа из склянки обычную проб-
Рис. 8. Собирание метана
на болоте.
ку заменяют на пробку с двумя отверстиями, в которые вставлены стеклянные трубки. (Склянку при этом необходимо держать повернутой вверх дном!) После этого в склянку вливают воду через трубку, доходящую до дна. Вытесняемый газ собирают в пробирку над водой и проверяют на отсутствие воздуха, после чего с ним можно делать те или иные опыты.
 2. В стакан большой емкости (диаметром 10-15 см) помещают болотный ил с возможно большим содержанием листочков и залипают его водой (рис. 9). Ил закрывают воронкой большого диаметра и засасывают в нее воду до самого зажима, после чего зажим закрывают. Прибор ставят в теплое место на несколько дней. К. моменту демонстрации часть воронки оказывается заполненной газом. Если ил пошевелить палкой, то ясно видно выделение из него пузырьков газа. Метан может быть подожжен у конца оттянутой трубки, если открыть зажим и воронку погрузить глубже в воду.
2. В стакан большой емкости (диаметром 10-15 см) помещают болотный ил с возможно большим содержанием листочков и залипают его водой (рис. 9). Ил закрывают воронкой большого диаметра и засасывают в нее воду до самого зажима, после чего зажим закрывают. Прибор ставят в теплое место на несколько дней. К. моменту демонстрации часть воронки оказывается заполненной газом. Если ил пошевелить палкой, то ясно видно выделение из него пузырьков газа. Метан может быть подожжен у конца оттянутой трубки, если открыть зажим и воронку погрузить глубже в воду.
Опыты с природным газом. Для изучения свойств метана можно воспользоваться природным газом, если подводка его имеется в школьном химическом кабинете. Метан, как известно, составляет основную часть этого газа.
Наличие небольшого количества примесей (СО2, N2 и др.) не мешает проведению опытов. Если перед поступлением в газовую сеть природный газ смешивается с другими видами газообразного топлива (например, с коксовым газом), то его следует предварительно освободить от примеси непредельных углеводородов, пропустив через склянку с раствором перманганата калия.
Природный газ для опытов можно собрать в газометр или же непосредственно использовать его из газовой проводки, пропустив предварительно через промывалку.
Пользуясь природным газом, можно, применяя приемы, описанные выше, показать, что метан легче воздуха, нерастворим в воде, не окисляется обычными окислителями (КМпО4), горит и образует взрывчатые смеси с кислородом и воздухом. Аналогично идут также опыты хлорирования метана.
Можно показать полное и неполное горение природного газа. Если поджигать газ, выходящий из тонкой стеклянной трубочки, то пламя оказывается почти невидимым, так как окружающего
струю газа воздуха хватает для полного сгорания. Если же для опыта воспользоваться широкой трубкой, газ не сможет хорошо смешиваться с воздухом, кислорода не хватит для полного сгорания газа и будет заметно образование копоти — выделение свободного углерода в результате термического распада несгорающей части метана. Осадок сажи можно получить, если в пламя внести стеклянную пластинку или какой-либо фарфоровый предмет.
На основании этого опыта могут быть обсуждены промышленный способ получения сажи и условия рационального сжигания газообразного топлива.
ГОМОЛОГИ МЕТАНА
Опыты с пропаном. Из газообразных предельных углеводородов наиболее доступным объектом изучения в школе становится пропан.
Пропан в баллоне находится в жидком состоянии под давлением 16 ат. При снижении давления с помощью редуктора, установленного на баллоне, пропан переходит в газообразное состояние и может быть использован для опытов. При пользовании баллоном в целях безопасности следует строго руководствоваться указаниями прилагаемой инструкции.
Для удобства работы можно предварительно заполнить пропаном газометр. Заполнение производится обычным способом с соблюдением всех правил предосторожности. Особенно нужно следить, чтобы в газометр с пропаном не проник воздух. С этой целью, в частности, воздух из трубки, по которой пропан будет поступать в газометр, должен быть сначала вытеснен в атмосферу.
1. Пропан тяжелее воздуха. Опыты ставят аналогично тому, как они проводились с метаном (с. 29).
Уравновешивают на весах две колбы одинакового объема (в отличие от прежнего опыта обе колбы стоят на чашках весов в обычном положении). В одну из колб пропускают из газометра пропан. Колба с пропаном оказывается тяжелее, чем колба с воздухом. Учащиеся без труда делают вывод об относительной плотности пропана по воздуху.
2. Подтверждение качественного состава пропана. Поскольку учащиеся (на примере метана) ознакомились со способом установления качественного состава газообразного углеводорода, целесообразно повторить данный опыт и убедиться в наличие углерода и водорода в пропане. Внимание! Если сжигание пропана будет проводиться из отводной трубки газометра, то газ предварительно должен быть проверен на чистоту!
3. Пропан — высококалорийное топливо. При характеристике свойств и применения пропана очень важно обратить внимание учащихся на высокую теплоту его сгорания. Так если для метана, являющегося основой природного газа, эта величина равна 890 кдж/моль, то для пропана теплота сгорания более 2200 кдж/моль, а у бутана даже 2800 кдж/моль.
Учащимся не сразу бывает понятно, почему резко возрастает тепловой эффект реакции горения гомологов метана. Иногда они говорят, что поскольку бытовой газ «жидкий», то в единице объема сгорает большее число молекул и, следовательно, больше образуется теплоты. В таком случае надо обратить внимание, что пропан (бутан) горит после испарения, т.е. в газообразном состоянии, поэтому, согласно закону Авогадро, следует считать, что в равных объемах метана и пропана содержится равное число молекул.
В таком случае различие в тепловом эффекте объясняется, очевидно, составом молекул. В самом деле, при сгорании молекулы метана вступают в реакцию с кислородом один атом углерода и четыре атома водорода, при сгорании же молекулы пропана С3Н8 окисляется три атома углерода и восемь атомов водорода. Очевидно, что вторая реакция идет со значительно большим положительным тепловым эффектом. Понятно, что при сгорании равного объема бутана С4Н10 образуется еще больше теплоты.
Поджигают пропан у отводной трубки газометра (проба на чистоту!). Обращают внимание прежде всего на то, что даже у трубки с малым диаметром он горит коптящим пламенем. Объясняют это явление большим, чем у метана, содержанием атомов углерода в молекуле вещества.
4. Отношение пропана к окислителям. Если при изучении метана исследовалось отношение его к таким окислителям, как перманганат калия, следует спросить учащихся: как можно проверить, окисляется ли этим веществом пропан. Учащиеся сами выполняют опыты — пропускают пропан через раствор перманганата калия, приливают раствор окислителя в цилиндр с пропаном и взбалтывают содержимое цилиндра. По отсутствию изменений в окраске раствора судят о принадлежности пропана к предельным углеводородам.
5. Реакция замещения водорода хлором. Опыт хлорирования пропана можно поставить проще, чем аналогичный опыт с метаном. Здесь достаточно приготовить в стеклянном цилиндре смесь пропана с хлором и наблюдать, какие изменения в ней произойдут через несколько часов или суток (смесь не выставлять на прямой солнечный свет!).
Смесь газов готовят одним из способов, описанных выше (с. 32). Можно поступить и по-другому. Сперва заполняют цилиндр пропаном по способу вытеснения воздуха, затем пропускают в цилиндр хлор, опустив подводящую газ трубку до дна сосуда. Когда хлором будет вытеснена половина пропана (о чем можно судить по уровню зеленой окраски в цилиндре), пропускание хлора прекращают, закрывают цилиндр пробкой и тщательно перемешивают газы.
Доказательство качественного состава высших углеводородов. Опыты с высшими углеводородами в школе обычно не ставятся. Между тем важно было бы показать учащимся, что твердые углеводороды, как и газообразные, имеют тот же качественный состав. Способ определения качественного состава твердых углеводородов имеет много общего с определением наличия углерода и водорода во многих других органических веществах.
В пробирке с отводной трубкой нагревают смесь мелко измельченного парафина (парафиновой свечи) или вазелинового масла с порошком оксида меди. Выделяющийся при реакции газ пропускают в известковую воду. Наблюдают помутнение известковой воды, образование капелек влаги на стенках пробирки и появление небольшого налета красной меди. Образование углекислого газа и воды при реакции свидетельствует о наличии углерода и водорода в парафине. Кислород для окисления этих элементов доставляется оксидом меди, в результате чего выделяется чистая медь.
Дата добавления: 2018-11-26; просмотров: 971;











