Контактное окисление оксида серы (IV).
SO2 + 0,5O2 = SO3 + Q (4.2.)
Реакция окисления сернистого газа в серный простая, обратимая, экзотермическая.
С термодинамической точки зрения для смещения равновесия в сторону образования продукта необходимо: снижать температуру, увеличивать давление, использовать избыток одного из компонентов, а также выводить продукт из зоны реакции.
С кинетической точке зрения для увеличения скорости процесса необходимо повышать температуру. Однако, даже при высоких температурах реакция в газовой фазе не идет из-за высокой энергии активации. Для ее снижения процесс окисления сернистого газа в серный проводят на поверхности твердого катализатора.
Выбор оптимальных условий проведения процесса.
1. Катализатор.
Процесс окисления диоксида серы с заметной скоростью для различных катализаторов начинается при определенной температуре – температуре зажигания. Реакция ускоряется в присутствии платины (Е=70 кДж/моль) при температуре 2500С, оксида железа (III) ( Е=150 кДж/моль) при температуре 5500С, оксида ванадия (V) при температуре не ниже 4000С ( Е= 90 кДж/моль).
Платиновый катализатор обладает наибольшей активностью, однако дорог и быстро отравляется ядами (мышьяком, селеном, хлором). Оксид железа (III) – малоактивный катализатор.
Ванадиевая контактная масса, например, марки БАВ имеет примерный состав: V2O5* 0,5Al2O3*2K2O*3BaO*2KCl*12SiO2/
Активными компонентами ванадиевых катализаторов являются сульфо- и пиросульфованадаты калия, которые в условиях проведения реакции находятся в расплавленном состоянии на поверхности кремнеземистого носителя. Формы контактной массы – гранулы, кольца. Рабочий интервал температур 400-6500С. При температурах выше 6500С активность катализатора уменьшается из-за разрушения активного комплекса V2O5K2S2O7 до кристаллического пентаоксида ванадия, который катализатором не является. При температурах ниже 4000С возможно образование каталитически неактивного соединения – сульфата ванадила VOSO4.
Гетерогенно-каталитический процесс окисления диоксида серы в триоксид состоит из следующих стадий:
1). Перенос газообразных веществ из объема к поверхности катализатора ( внешняя диффузия).
2). Диффузия реагирующих веществ внутри пор катализатора (внутренняя диффузия).
3). Абсорбция SO2 и O2 на катализаторе.
4). Химическое взаимодействие исходных веществ с участием катализатора.
5). Десорбция SO3.
6). Диффузия SO3 внутри зерна катализатора к его поверхности (внутренняя диффузия).
7). Отвод продукта реакции в газовую фазу (внешняя диффузия).
Скорость всего процесса определяется скоростью наиболее медленной стадии. В выбранных условиях общая скорость окисления серы (IV) определяется скоростью химической реакции, т.е. протекает в кинетической области.
2. Температура.
Температура выбирается в пределах работы катализатора. Для получения высокого выхода оксида серы (VI) необходима минимальная температура- 4000С, так как реакция обратимая и экзотермическая. Однако скорость процесса при этой температуре мала даже в присутствии катализатора.
Выбор температурного режима, обеспечивающего высокую скорость обратимой экзотермической реакции, довольно сложен, так как изменение температуры различно сказывается на равновесном выходе продукта и на средней скорости процесса.
Если вести процесс при постоянной температуре 6000С, то реакция идет быстро, но, в соответствии с состоянием равновесия, выход целевого продукта уменьшается.
Если вести процесс при постоянной температуре 4000С, получим высокий выход, однако скорость процесса будет чрезвычайно мала.
Для обеспечения высокой интенсивности процесса необходимо проводить окисление оксида серы (IV) при меняющемся температурном режиме.
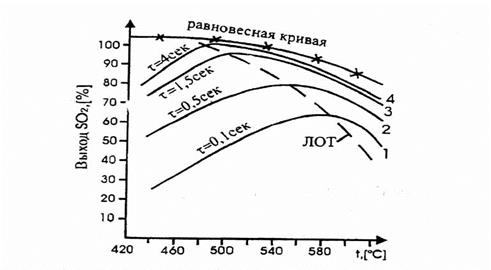
Рис.4.2. Зависимость практического выхода SO3 от температуры при различном времени контактирования.
На рис.4.2 приведен график зависимости равновесного и практических выходов от температуры. С увеличением времени контактирования максимумы на кривых смещаются в сторону более низких температур. Кривую, соединяющую эти максимумы, называют линией оптимальных температур (ЛОТ). При проведении процесса по линии оптимальных температур окисление оксида серы (IV) протекает с максимально возможными скоростями в каждый момент. Понижение температуры к концу процесса с 600 до 4000С позволяет получить высокий выход продукта.
3. Давление.
Процесс идет с уменьшением объема, поэтому для смещения равновесия вправо необходимо давление увеличивать. В зависимости от выбранной температуры эффективность воздействия давления различна. При низких температурах, когда равновесные степени контактирования оксида серы (IV) высокие, давление незначительно сказывается на смещении равновесия. При высоких температурах, когда окисление происходит далеко не полностью, давление может стать одним из решающих факторов, обеспечивающих высокую степень контактирования. Повышенное давление имеет значение для агрегатов большой единичной мощности.
В обычных условиях процесс проводят при давлении 0,1 МПа, так как смещения равновесия добиваются другими путями. Степень превращения SO2 составляет в среднем 99,5-99,8%.
4. Соотношение исходных компонентов.
При стехиометрическом соотношении превращение протекает недостаточно полно. Для смещения равновесия в сторону продукта реакции необходимо брать в избытке один из компонентов. Наиболее оптимальным является следующий состав газовой смеси: 11%O2, 7%SO2, 82%N2, т.е. кислород подают в избытке. Если взять избыток диоксида серы, то произойдет перегрев катализатора, что может вывести его из строя.
Таким образом, процесс окисления оксида серы(IV) в оксид серы (VI) является: простым, обратимым, экзотермическим, гетерогенно-каталитическим. Для получения максимальных выхода и скорости процесса его проводят по линии оптимальных температур (ЛОТ).
Конструкция контактного аппарата должна обеспечить возможность проведения каталитического окисления диоксида серы в условиях оптимального технологического режима. В контактном аппарате расположены пять слоев катализатора. Сначала газ проходит первые три слоя, причем, для реализации линии оптимальных температур он выводится после прохождения каждого слоя в выносные теплообменники для охлаждения.

Рис. 4.3. Изменение температуры и выхода при четырехступенчатом контактировании в аппарате со стационарными слоями катализатора:
1, 3, 5, 7 –слои катализатора, 2, 4, 6, 8 – промежуточные теплообменники.
После третьего слоя газ попадает в моногидратный абсорбер и затем подается на 4 и 5 слои катализатора. Т.е. процесс окисления диоксида серы проводят по методу двойного контактирования, (рис.4.4.)
Вывод продукта из зоны реакции смещает равновесие в сторону образования целевого продукта.
3. Абсорбция триоксида серы.
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту.
Абсорбция SO3 является гетерогенным процессом и скорость его равна: r = k.F.( 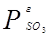 -
- 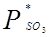 ), где
), где 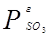 - давление газа,
- давление газа, 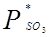 - парциальное давление, давление паров SO3 над растворителем.
- парциальное давление, давление паров SO3 над растворителем.
Для увеличения движущей силы процесса необходимо, чтобы парциальное давление паров SO3 было минимальным. Однако в качестве абсорбента нельзя использовать растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергироваться в инертной газовой среде – азоте, т.е. с образованием сернокислотного тумана.
Оптимальным абсорбентом является 98,3% серная кислота – моногидрат, соответствующий азеотропному составу. Над поверхностью такой кислоты практически нет ни паров воды, ни паров SO3.
Протекающий при этом процесс можно условно описать уравнением:
SO3 + mH2SO4 + H2O = (m + 1) H2SO4 + Q (4.3.)
Использование в качестве поглотителя менее концентрированной кислоты может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой в паровой фазе довольно велико равновесное парциальное давление SO3, поэтому он будет абсорбироваться не полностью.
При высоких температурах над 98,3%-ной серной кислотой может быть значительным парциальное давление самой кислоты, что также будет снижать степень абсорбции SO3. Ниже 1000С равновесное давление паров серной кислоты очень мало и поэтому может быть достигнута практически 100%-ная степень абсорбции.
Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 1000С.
Технологическая схема производства серной кислоты из серы по методу двойного контактирования (ДК) изображена на рис.12.4.

Рис.4.4. Схема производства серной кислоты из серы по методу ДК.
1 –серная печь, 2 –котел-утилизатор, 3 –экономайзер, 4 –пусковая топка, 5, 6 –теплообменники пусковой топки, 7 –контактный аппарат, 8 –теплообменники, 9 –сушильная башня, 10, 11 – первый и второй моногидратные абсорберы, 12 –сборники кислоты, 13 –выхлопная труба.
Серу подают в печь 1, пропуская через плавитель, где она плавится. Также в печь 1 подают воздух, осушаемый в сушильной башне 9, орошаемой 93% серной кислотой. Воздух предварительно нагревается в теплообменниках-8.2, 8.3. Из печи 1 газ (SO2) поступает в котел-утилизатор 2, где охлаждается до 4400С и направляется в контактный аппарат 7. Воздух нагревается в топке 4, в теплообменниках 5 и 6 и направляется в контактный аппарат. В контактном аппарате размещены пять слоев катализатора.
Для реализации линии оптимальных температур газ после каждого слоя катализатора необходимо охладить. С этой целью предусмотрена система теплообменников 8.
Таким образом, газовая смесь (SO2 и воздух) после первого слоя катализатора направляется в теплообменник 8.1, затем на второй слой катализатора. После второго слоя газ охлаждается в теплообменнике 8.4 и поступает на третий слой катализатора. После третьего слоя газ, пройдя теплообменники 8.5, 8.2, 8.3, направляется в первый моногидратный абсорбер 10, который орошается 98,3% серной кислотой. После первого моногидратного абсорбера газ поступает на четвертый слой катализатора в контактном аппарате, предварительно пройдя теплообменники 8.3, 8.2 и 8.5. После четвертого слоя вводят дополнительно воздух для охлаждения и интенсификации процесса. После четвертого слоя газ поступает на пятый слой, выходит из контактного аппарата и направляется для подогрева воды в экономайзер 3 и уже оттуда попадает во второй моногидратный абсорбер 11, где происходит окончательное поглощение триоксида серы. Выхлопные газы отводятся из второго моногидратного абсорбера через выхлопную трубу 13. Товарная серная кислота – 92,5% постоянно выводится из сушильной башни 9.
Важнейшими тенденциями развития производства серной кислоты являются: повышение концентрации SO3 в технологических газах, циклическая система производства, разработка низко-температурных катализаторов, использование теплоты реакций на всех стадиях для выработки водяного пара.
Глава 5.
Дата добавления: 2021-01-11; просмотров: 701;











