Массы реагирующих друг с другом веществ пропорцианальны их
эквивалентам или эквивалентным массам:
 =
= 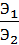 . (2.1)
. (2.1)
Из закона следует, что при любом химическом взаимодействии один эквивалент вещества всегда реагирует с одним эквивалентом другого вещества.
Химический эквивалент (n) элемента или соединения – это такое его количество, которое может провзаимодействовать (реально или формально) с 1 моль атомов водорода или заместить его в химических реакциях.
Единицей химического эквивалента является моль.
ПРИМЕР:
n (H2) = 1/2 моль; n (О2) = 1/4 моль; n (СО) =1/2 моль; n (СО2) = 1/4 моль
ЭКВИВАЛЕНТНАЯ МАССА (Эm)– это масса одного эквивалента вещества. Эквивалентная масса элемента или соединения рассчитывается по формуле:
Э =М  n, где М – молярная масса элемента или соединения, n – химический эквивалент этого элемента или соединения.
n, где М – молярная масса элемента или соединения, n – химический эквивалент этого элемента или соединения.
ПРИМЕР: Эm (Н2) = 2 г/моль 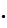 1/2 моль = 1 г .
1/2 моль = 1 г .
Эm (О2) = 32 г/моль 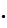 1/4 моль = 8 г .
1/4 моль = 8 г .
Эm (SiO) = 28 г/моль 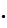 1/2 моль = 14 г .
1/2 моль = 14 г .
Эm (SiO2) = 44 г/моль 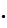 1/4 моль = 11 г .
1/4 моль = 11 г .
Эm (Cr2O3) = 152 г/моль 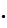 1/6 моль = 25,3 г .
1/6 моль = 25,3 г .
ЭКВИВАЛЕНТНЫЙ ОБЪЕМ (Эv,л) –это объем, занимаемый одним эквивалентом газообразного вещества. Эквивалентный объем газа находят умножением молярного объема газа на его эквивалент Эv = VM 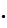 n.
n.
ПРИМЕР: Эv (Н2) = 22,4 л/моль 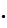 1/2 моль = 11,2 л .
1/2 моль = 11,2 л .
Эv (О2) = 22,4 л/моль 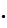 1/4 моль = 5,6 л .
1/4 моль = 5,6 л .
Эv (Сl2) = 22,4 л/моль 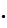 1/2 моль = 11,2 л .
1/2 моль = 11,2 л .
Таким образом, эквивалент составляет некоторую часть моля или равен ему, а эквивалентная масса равна такой же части молярной массы или равна ей. Эквивалентный объем равен такой же части молярного объема или равен ему.
Для расчетов в окислительно-восстановительных реакциях используется понятие окислительно-восстановительного эквивалента (redox эквивалент).Это такое количество элемента или соединения, которое может отдать или присоединить 1 моль электронов.
Химический эквивалент KМnO4 = 1 моль, а его окислительно-восстановительный эквивалент непостоянен и зависит от числа электронов,
присоединяемых в окислительно-восстановительной реакции.
ПРИМЕР: РЕАКЦИЯ REDOX ЭКВИВАЛЕНТ
MnO4- +8H+ +5e = Mn2+ +4H2O 1/5 моль
MnO4- + 2 H2O +3е = MnO2 + 4OH- 1/3 моль
MnO4- + е = MnO42- 1 моль
На количественное соотношение реагирующих веществ в уравнениях химических реакций указывают стехиометрические коэффициенты, стоящие перед символом веществ: 3H2 + N2 = 2NH3. Стехиометрические коэффициенты могут указывать на соотношение взаимодействующих частиц (атомов, молекул, ионов) или их молей.
ЗАКОН АВОГАДРО
В равных объемах любых газов, находящихся при одинаковых температуре и давлении, содержится одинаковое число молекул.
Из закона Авогадро следует, что 1 моль любого газа занимает одинаковый объем.
При нормальных условиях (н.у.) (Т=273К или 00С и Р=101325 Па или 1 атм или 760 мм. рт. ст.) этот объем называется молярным (VМ ) и равен 22,4 л.
Дата добавления: 2021-01-26; просмотров: 589;











