Примеры решения типовых задач.
Пример 1. Составление формулы и диссоциация комплексного соединения, вычисление заряда комплексного иона.
Задача 1. Составьте формулу сульфата гексаамминкобальта (II). Напишите уравнение диссоциации этого соединения в водном растворе, определите заряд комплексного иона.
Решение. Координационное число кобальта (II), согласно названию (гексаамминкобальт), равно шести, поэтому он образует комплексный ион [Co(NH3)6]2+. Заряд иона равен +2, так как ион кобальта имеет заряд +2, а молекулы аммиака нейтральны.
Комплексное соединение имеет формулу [Co(NH3)6]SO4 и диссоциирует в водном растворе на комплексный ион и противоион внешней сферы:
[Co(NH3)6]SO4  [Co(NH3)6]2+ + SO42-.
[Co(NH3)6]2+ + SO42-.
Пример 2. Способы разрушения комплексных соединений.
Задача 1. Предложите способ разрушения комплексного соединения [Co(NH3)6]SO4..
Решение. Комплекс [Co(NH3)6]2+ содержит в качестве лигандов молекулы аммиака, обладающие основными свойствами. Поэтому естественным способом разрушения этих комплексов является связывание молекул аммиака протонными кислотами. Процесс разрушения комплексов можно представить сложным равновесием, являющегося сочетанием простых равновесий (1) и (2):
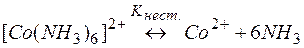
| (1) | |

| (2) | |

| (3) |
Умножая уравнение (2) на 6 и суммируя левые и правые части равновесий (1) и (2), приходим к суммарному уравнению реакции (3). Константы равновесий (1), (2) и (3) выражаются через их равновесные концентрации следующими равенствами:
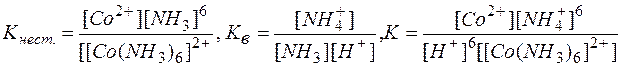
Сопоставляя эти выражения, можно видеть
К= Кнест..Кв6 (4)
Подставляя табулированные значения для Кнест. и Кв в выражение (4), имеем:
К = 7,8 . 10-6 . (1,73 . 109)6 = 2,09 . 1050
Полученное значение константы равновесия К очень велико. Это указывает на то, что суммарное равновесие (3) нацело смещено в правую сторону, т.е. комплекс [Co(NH3)6]2+ полностью разрушен.
Задача 2. Можно ли разрушить комплексное соединение [Ag(NH3)2]NO3 воздействием соли KI?
Решение. Представим процесс разрушения комплекса системой простых равновесий (5) и (6):
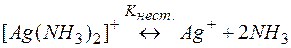 (5)
(5)
 (6)
(6)
___________________________________________________________
 (7)
(7)
Суммирование левых и правых частей этих равновесий приводит к уравнению разрушения комплекса (7). По аналогии с вышеприведенными рассуждениями в примере 1 можно показать, что
К = Кнест. . Кос. (8)
Подставляя в равенство (8) табулированное значение для Кнест.. и Кос. приходим к значению К:
К = 7,94 .10–8 . 1016 = 7,94 . 108

 Высокое значение константы К указывает на практически полное смещение равновесия (7) в правую сторону, т.е. комплекс [Ag(NH3)2]+ разрушен.
Высокое значение константы К указывает на практически полное смещение равновесия (7) в правую сторону, т.е. комплекс [Ag(NH3)2]+ разрушен.
Задача 3. Можно ли разрушить комплексное соединение Na[Ag(CN)2] воздействием на него KCl? 
Решение. Процесс разрушения комплекса [Ag(CN)2]– можно представить равновесиями (9) и (10):
 (9)
(9)
 (10)
(10)
___________________________________________________________
 (11)
(11)
Суммирование левых и правых частей уравнений (9) и (10) приводит к равновесию разрушения комплекса (11). Можно показать, что
К = Кнест. . Кос.
При подстановке численных значений Кнест. и Кос. в последнее выражение имеем
К = 10–21 . 0,912 . 1010 = 0.912 . 10–11
Низкое значение константы К указывает, что равновесие брутто-реакции (11) практически нацело смещено в левую сторону. Таким образом, комплекс [Ag(CN)2]– невозможно разрушить воздействием анионов Cl–.
Дата добавления: 2016-10-07; просмотров: 1676;











