КОРРОЗИЯ И ЗАЩИТА МЕТАЛЛОВ И СПЛАВОВ
ОТ КОРРОЗИИ
Коррозией называют самопроизвольное разрушение металлов и сплавов вследствие физико–химического взаимодействия их с окружающей средой.
По механизму протекания процесса различают коррозию химическую и электрохимическую.
Химическая коррозия протекает в неэлектропроводных средах (сухая атмосфера воздуха, растворы неэлектролитов). Химическая коррозия представляет собой непосредственное взаимодействие металла с окислителем, то есть процессы окисления и восстановления протекают одновременно и на одном и том же участке поверхности:
4Fe + 3O2 = 2Fe2О3
2  2Fe – 6e
2Fe – 6e  2Fе3+ (окисление)
2Fе3+ (окисление)
3 O2 + 4е  2O2- (восстановление)
2O2- (восстановление)
Электрохимическая коррозия протекает в электропроводных средах: растворы электролитов, влажная атмосфера воздуха (относительная влажность воздуха больше 65%).
Наличие электропроводной среды делает возможной работу большого числа небольших по размеру гальванических элементов (микрогальванопар). Причиной образования на поверхности металла гальванических элементов является то, что большинство технически важных металлов имеют в своем составе примеси или даже специально вводимые добавки. Поэтому отдельные участки поверхности металла имеют более положительное, другие – более отрицательное значение потенциала (электрохимическая неоднородность поверхности).
Основной причиной коррозии является термодинамическая неустойчивость металла или сплава в той или иной коррозионной среде. Критерием термодинамической вероятности коррозии является уменьшение изобарно - изотермического потенциала ( 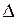 G < 0). В электрохимических процессах изменение изобарно - изотермического потенциала определяется по формуле
G < 0). В электрохимических процессах изменение изобарно - изотермического потенциала определяется по формуле
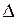 G = –nF
G = –nF 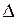 E ,
E ,
где: n - число электронов, принимающих участие в реакции;
F - число Фарадея;
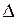 Е - разность потенциалов, при которых протекают катодные и анодные процессы (
Е - разность потенциалов, при которых протекают катодные и анодные процессы (  ).
).
Если 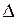 Е > 0, т.е.
Е > 0, т.е.  , то ∆G < 0, и процесс коррозии протекает самопроизвольно.
, то ∆G < 0, и процесс коррозии протекает самопроизвольно.
Приближенная оценка степени термодинамической нестабильности различных металлов в наиболее распространенных коррозионных средах может быть сделана по величине стандартных электродных потенциалов (см. таблицу «Стандартные электродные потенциалы металлов» Приложения), что примерно соответствует потенциалу окисления металла в анодном процессе Еа.
Наиболее распространенными коррозионными средами являются водные растворы электролитов, содержащие в качестве окислителя растворенный кислород или ионы водорода, то есть чаще всего коррозионный процесс протекает с кислородной или водородной деполяризацией. Величины потенциалов, соответствующих катодному процессу ЕК в наиболее распространенных коррозионных средах, представлены в таблице 1, в которой выделены 4 группы металлов, термодинамически неустойчивых в той или иной среде (∆G <0, если ЕК>ЕА).
Особое место среди металлов занимает золото (ЕОAu/Au3+ = + 1,5В), которое является термодинамически устойчивым во всех наиболее распространенных коррозионных средах, указанных в таблице 1.
Таблица 1. Классификация металлов по термодинамической неустойчивости в различных средах
| Коррозионные среды | Катодный процесс (кислородная или водородная деполяризация) | Еок, в | Группы металлов, для которых ∆G <0 | Потенциалы анодов*, ЕоА, В (ЕоМе / Ме п+ ) |
| Нейтральная среда в отсутствии растворенного кислорода | 2Н2О +2е = Н2 +2ОН– | -0,413 | I Li…Fe | -3,01<E< -0,413 |
| Кислая среда в отсутствии растворенного кислорода | 2Н+ +2е =Н2 | 0,00 | II Li…W | -3,01<E< 0,00 |
| Нейтральная среда в присутствии растворенного кислорода и влажная атмосфера | О2+2Н2О +4е = 4ОН– | +0,815 | III Li…Ag | -3,01<E< +0,815 |
| Кислая среда в присутствии растворенного кислорода и влажная атмосфера промышленных районов | О2+ 4Н+ +4е = 2Н2О | +1,23 | IV Li…Bi | -3,01<E< +1,23 |
*Анодные процессы для всех металлов можно представить в общем виде:
Ме – пе = Меп+
Дата добавления: 2016-10-07; просмотров: 1788;











