I класс - ОКСИДОРЕДУКТАЗЫ.
ОБЩИЕ СВОЙСТВА КАТАЛИЗАТОРОВ
1. Катализаторы сами НЕ ВЫЗЫВАЮТ химическую реакцию, а только УСКОРЯЮТ реакцию, которая протекает и без них.
2. Не влияют на энергетический итог реакции.
3. В обратимых реакциях катализаторы ускоряют как прямую, так и обратную реакцию, причем в ОДИНАКОВОЙ степени, из чего следует, что катализаторы:
а) НЕ ВЛИЯЮТ на НАПРАВЛЕННОСТЬ обратимой реакции, которая определяется только соотношением концентраций исходных веществ (субстратов) и конечных продуктов;
б) НЕ ВЛИЯЮТ на ПОЛОЖЕНИЕ РАВНОВЕСИЯ обратимой реакции, а только ускоряют его достижение.
ОСОБЕННОСТИ ФЕРМЕНТОВ КАК БИОЛОГИЧЕСКИХ КАТАЛИЗАТОРОВ
Ферменты обладают всеми общими свойствами обычных катализаторов. Но, по сравнению с обычными катализаторами, все ферменты являются белками. Поэтому они обладают особенностями, отличающими их от обычных катализаторов. Эти особенности ферментов, как биологических катализаторов, иногда называют общими свойствами ферментов. К ним относятся:
1. Высокая эффективность действия. Ферменты могут ускорять реакцию в 108 -1012 раз (примеры смотрите в пособии «Ферменты», стр.7-8).
2. Высокая избирательность ферментов к субстратам (субстратная специфичность) и к типу катализируемой реакции (специфичность действия) (смотрите примеры в пособии "Ферменты", стр. 14-15);
3. Высокая чувствительность ферментов к неспецифическим физико-химическим факторам среды - температуре, рН, ионной силе раствора и т.д. (смотрите пособие "Ферменты" стр.10, 12-13);
4. Высокая чувствительность к химическим реагентам;
5. Высокая и избирательная чувствительность к физико-химическим воздействиям тех или иных химических веществ, которые благодаря этому могут взаимодействовать с ферментом, улучшая или затрудняя его работу (об активаторах и ингибиторах смотрите пособие "Ферменты", стр. 27-36).
СТРОЕНИЕ ФЕРМЕНТОВ
Субстратом (S) называют вещество, химические превращения которого в продукт (Р) катализирует фермент (Е). Тот участок поверхности молекулы фермента, который непосредственно взаимодействует с молекулой субстрата, называется АКТИВНЫМ ЦЕНТРОМ ФЕРМЕНТА.
АКТИВНЫЙ ЦЕНТР ФЕРМЕНТА
Активный центр фермента образован из остатков аминокислот, находящихся в составе различных участков полипептидной цепи или различных полипептидных цепей, пространственно сближенных. Образуется на уровне третичной структуры белка-фермента.
В его пределах различают АДСОРБЦИОННЫЙ УЧАСТОК (центр) и КАТАЛИТИЧЕСКИЙ УЧАСТОК (центр). Кроме того, вне активного центра фермента встречаются особые функциональные участки; каждый из них обозначают термином АЛЛОСТЕРИЧЕСКИЙ ЦЕНТР.
КАТАЛИТИЧЕСКИЙ ЦЕНТР - это та область (зона) активного центра фермента, которая непосредственно участвует в химических преобразованиях субстрата. Формируется он за счет радикалов двух, иногда трех аминокислот, расположенных в разных местах полипептидной цепи фермента, но пространственно сближенных между собой за счет изгибов этой цепи. Например, каталитический центр "серин-гистидиновых" ферментов формируется за счет радикалов аминокислот серина и гистидина. Если фермент является сложным белком, то в формировании каталитического центра нередко участвует простетическая группа молекулы фермента (кофермент). Коферментную функцию выполняют все водорастворимые витамины и жирорастворимый витамин K. (подробнее о коферментной функции витаминов: пособие "Ферменты", стр.11).
АДСОРБЦИОННЫЙ ЦЕНТР - это участок активного центра молекулы фермента, на котором происходит сорбция (связывание) молекулы субстрата. Он формируется одним, двумя, чаще тремя радикалами аминокислот, которые обычно расположены рядом с каталитическим центром. Главная его функция - связывание молекулы субстрата и передача этой молекулы каталитическому центру в наиболее удобном положении (для каталитического центра). Эта сорбция происходит ТОЛЬКО ЗА СЧЕТ СЛАБЫХ ТИПОВ СВЯЗЕЙ и потому ЯВЛЯЕТСЯ ОБРАТИМОЙ. По мере формирования этих связей происходит конформационная перестройка адсорбционного центра, которая приводит к более тесному сближению субстрата и активного центра фермента, более точному соответствию между их пространственными конфигурациями. Такое соответствие - не заранее "готовое", а формирующееся в ходе взаимодействия - американский ученый Кошленд положил в основу теории ИНДУЦИРОВАННОГО СООТВЕТСТВИЯ (или «НАВЕДЕННОГО» СООТВЕТСТВИЯ), которая преодолела ограниченность существовавшей ранее теории КЛЮЧА И ЗАМКА (жесткого соответствия структуры субстрата структуре адсорбционного центра).
Очевидно, что именно структура адсорбционного центра определяет субстратную специфичность фермента, то есть требования фермента к молекуле химического вещества, чтобы она могла стать для него подходящим субстратом.
Некоторые вещества, обладающие подходящими характеристиками (то есть похожие на субстрат), могут тоже связываться с адсорбционным центром фермента. Но если в их молекуле нет такой химической связи, на которую может воздействовать каталитический центр данного фермента, то химических превращений этого вещества не произойдет. Занимая активный центр фермента, такие молекулы блокируют его работу, то есть являются ОБРАТИМЫМИ ИНГИБИТОРАМИ данного фермента (обратимыми, потому что связаны с ферментом слабыми типами связей). Повышая концентрацию субстрата, их можно ВЫТЕСНИТЬ из адсорбционного центра. Поэтому такие ингибиторы называют КОНКУРЕНТНЫМИ. Они конкурируют с истинным субстратом данного фермента за обладание его адсорбционным центром.
АЛЛОСТЕРИЧЕСКИМИ ЦЕНТРАМИ называют такие участки молекулы фермента вне его активного центра, которые способны связываться СЛАБЫМИ ТИПАМИ СВЯЗЕЙ (значит - обратимо) с тем или иным веществом (лигандом). Причем такое связывание приводит к такой конформационной перестройке молекулы фермента, которая распространяется и на активный центр, облегчая, либо затрудняя (замедляя) его работу. Соответственно такие вещества называются АЛЛОСТЕРИЧЕСКИМИ АКТИВАТОРАМИ или АЛЛОСТЕРИЧЕСКИМИ ИНГИБИТОРАМИ данного фермента.
Термин "аллостерический" (то есть "имеющий иную пространственную структуру") появился в связи с тем, что эти эффекторы по своей пространственной конфигурации совсем не похожи на молекулу субстрата данного фермента (и потому не могут связываться с активным центром фермента). Было сделано заключение, что и аллостерический центр не похож по своей структуре на активный центр фермента.
Аллостерические центры найдены не у всех ферментов. Они есть у тех ферментов, работа которых может изменяться под действием гормонов, медиаторов и других биологически активных веществ. Некоторые искусственно синтезированные лекарства обладают биологической активностью потому, что их молекулы комплементарны аллостерическому центру некоторых ферментов организма.
СПЕЦИФИЧНОСТЬ ФЕРМЕНТОВ
Различают два главных вида специфичности ферментов: СУБСТРАТНУЮ СПЕЦИФИЧНОСТЬ и СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
СУБСТРАТНАЯ СПЕЦИФИЧНОСТЬ.
Это способность фермента катализировать превращения только одного определенного субстрата или же группы сходных по строению субстратов. Определяется структурой адсорбционного участка активного центра фермента.
Различают 3 типа субстратной специфичности:
1) АБСОЛЮТНАЯ субстратная специфичность - это способность фермента катализировать превращение только одного, строго определенного субстрата.
2) ОТНОСИТЕЛЬНАЯ субстратная специфичность - способность фермента катализировать превращения нескольких, сходных по строению, субстратов.
3) СТЕРЕОСПЕЦИФИЧНОСТЬ - способность фермента катализировать превращения определенных стереоизомеров.
Например, фермент оксидаза L-аминокислот способен окислять все аминокислоты, но относящиеся только к L-ряду. Таким образом, этот фермент обладает относительной субстратной специфичностью и стереоспецифичностью одновременно.
СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ.
Специфичность действия - это способность фермента катализировать только определенный тип химической реакции.
В соответствии со специфичностью действия все ферменты делятся на 6 классов. Классы ферментов обозначаются латинскими цифрами. Название каждого класса ферментов соответствует этой цифре.
КЛАССИФИКАЦИЯ ФЕРМЕНТОВ
I класс - ОКСИДОРЕДУКТАЗЫ.
К данному классу относятся ферменты, катализирующие окислительно-восстановительные реакции. При окислении может происходить либо отнятие водорода от окисляемого вещества, либо присоединение кислорода к окисляемому веществу. В зависимости от способа окисления различают следующие подклассы оксидоредуктаз:
1) ДЕГИДРОГЕНАЗЫ. Катализируют реакции, при которых происходит отнятие водорода от окисляемого вещества. Пример:
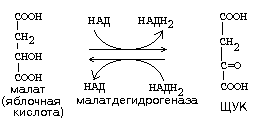
|
2) ОКСИГЕНАЗЫ. Ферменты этого подкласса катализируют включение кислорода в окисляемое вещество.
a) Монооксигеназы - включают один атом кислорода в окисляемое вещество.
Пример:
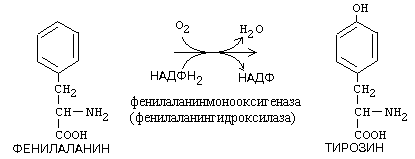
б)Диоксигеназы - включают 2 атома кислорода в окисляемое вещество. Часто это сопровождается разрывом циклической структуры. По месту разрыва связи (на рисунке обозначено стрелкой) присоединяются атомы кислорода.
Пример:
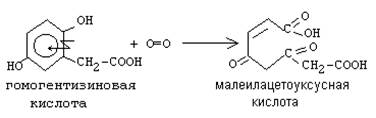
Дата добавления: 2016-06-22; просмотров: 2538;











