Определение подвижных форм соединений макро- и микроэлементов
Определение легкогидролизуемого азота по Тюрину и Кононовой
Значение анализа. Для оценки подвижности азота в почве важное значение имеет определение, наряду с нитратами и аммонием, легкогидро-лизуемых органических соединений этого элемента. При обработке почвы слабым раствором кислоты происходит переход аминокислот, амидов, аминосахаров и других легкогидролизуемых азотсодержащих органических соединений, а также минеральных форм азота (N-NO3 - + N-NO4-) в гидролизат. Поскольку легкогидролизуемые органические соединения быстро минерализуются, содержащийся в них азот рассматривается как ближайший резерв минерального азота в почве. Специальными исследованиями выявлена положительная корреляция между концентрацией легкогидролизуемого азота в почве, эффективностью азотных удобрений сельскохозяйственных культур.
Принцип метода. Почву на холоде обрабатывают 0,5 н. раствором серной кислоты при соотношении почвы и раствора 5:5. В гидролизате определяют общий азот объемным методом после перевода его в аммонийную форму. Метод учитывает присутствующие в кислотной вытяжке минеральные формы азота (N-NO3- + N-NO4 -) и легкогидролизуемый органический азот (аминокислот, амидов, легкогидролизуемые группы белков).
Ход анализа. На технических весах отвешивают 20 г воздушно-сухой почвы, просеянной через сито с диаметром отверстий 1 мм, из которой предварительно выбраны корешки. Навеску почвы помещают в коническую колбу емкостью 200 - 250 мл и приливают 100 мл 0,5 н. H2SO4. Встряхивают содержимое колбы в течение 3 мин и оставляют на 16 - 18 ч при комнатной температуре. Затем вытяжку фильтруют через сухой складчатый фильтр, давая фильтрату стечь полностью. В зависимости от предполагаемого содержания легкогидролизуемого азота пипеткой переносят 25 - 50 мл в коническую колбу емкостью 100 мл, прибавляют для восстановления нитратов до аммиака 0,5 г смеси цинковой пыли и восстановленного железа, закрывают воронкой и нагревают на закрытой электроплитке до слабого кипения и полного растворения прибавленной смеси.
После охлаждения обмывают воронку дистиллированной водой, из бюретки приливают в колбу 5 мл концентрированной H2SO4 (плотностью 1,84) и выпаривают раствор на слабом газовом пламени или электрической плитке до появления белых паров воды с оксидами серы или побурения жидкости в колбе. Охладив колбу, добавляют 2 мл 20%-ного раствора хромовой кислоты или 2,5 мл 10 % раствора дихромата калия (К2Сг2О7), закрывают ее маленькой воронкой и кипятят в течение 10 мин до появления интенсивной зеленой окраски раствора.
Содержимое конической колбы после охлаждения переносят в отгонную колбу Кьельдаля емкостью 300 - 500 мл, обмывают коническую колбу несколько раз дистиллированной водой с таким расчетом, чтобы общий объем жидкости в колбе Кьельдаля составил 100 - 120 мл. В отгонную колбу опускают несколько гранул цинка или пемзу. Перед этим в стакан емкостью 250 - 300 мл наливают 15 мл 0,02 н H2SO4, прибавляют 5 капель индикатора конго красного или Гроага. Данный стакан и служит приемником для отгоняемого аммиака. В отгонную колбу приливают 20 мл 50 % NaOH и быстро присоединяют ее к каплеуловителю прибора, который соединен со стеклянной трубкой, опущенной в приемник с 15 мл 0,02 н H2SО4. В течение 30 минут - 1 часа ведут отгонку аммиака.
Окончание отгонки азота определяют путем контрольной пробы с реактивом Несслера. Часть взятой в приемник кислоты идет на связывание аммиака; остаток же несвязанной H2SO4 оттитровывают 0,02 н щелочью (NaOH). При вычислении количества легкогидролизуемого азота в почве исходят из того, что 1 мл 0,02 н H2SO4 соответствует 0,28 мг азота. Содержание легкогидролизуемого азота (х) в миллиграммах на 1 кг почвы находят по формуле:
Х = 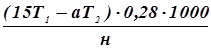
где 15 - количество 0,02 н H2SO4, взятой в приемный стакан при отгонке аммиака, мл;
Т1 - поправка к титру Н2SO4,
a - количество 0,02 NаОН, израсходованное на титрование несвязанной аммиаком кислоты в приемном стакане (за вычитанием контрольного анализа), мл;
Т2 - поправка к титру NaOH;
0,28 - масса N, соответствующая 1 мл 0,02 н H2SO4, мг;
1000 - коэффициентдля пересчета результатов анализа на 1 кг почвы;
н - навеска почвы, соответствующая объему анализируемого фильтрата (взятого для отгонки), г.
Реакции при гидролизе, отгоне и связывании аммиака.При обработке почвы 0,5 н H2SO4 происходит гидролиз органических соединений, в результате чего в раствор переходит, наряду с нитратами и аммонием, некоторое количество азота аминокислот, амидов и простых белков. При взаимодействии амидов с серной кислотой образуются органические кислоты и выделяется аммиак, который сразу же связывается избытком H2SO4;
R-CO-NH2+H2O+ H2SO4 = R-COOH + (NH4)2SO4.
Органические кислоты в дальнейшем окисляются дихроматом калия (К2Сг2О7) до СО2 и Н2О. Дихромат калия окисляет также аминокислоты по следующей схеме:
R-COO(NH2)-COОH + К2Сг2О7 + H2SO4 = Cr2(SO4)3 + (NH)2S04 + СО2 + Н2О.
В сильнокислой среде шестивалентный хром восстанавливается до трехвалентного, что сопровождается изменением красно-оранжевого цвета раствора дихромата калия в зеленый, присущий сульфату хрома.
2К2Сr2 О7 + 8H2SO4 = 2K2SO4 + 2Cr2(SO4)3 +8H2O + +ЗО2
Пары кипящей серной кислоты распадаются на серный ангидрид и воду:
H2SO4 = SO3 + Н2О.
В свою очередь, серный ангидрид распадается на диоксид серы и кислород:
2SO3 = 2SO2 + О2
Кислород участвует в окислении углерода тех органических соединений, которые перешли из почвы в кислотную вытяжку, до углекислого газа и воды, соответственно, а диоксид серы переводит азот аминогрупп (NН2) в аммиак, который связывается серной кислотой
2NH3+ H2SO4 = (NH4)2SO2.
Нитраты, находящиеся в вытяжке, при добавлении смеси цинка и железа восстанавливаются до аммиака:
H2SO4 + Fe =FeSO4+Н2О
HNO3 + Н2 = НNО2 + Н2О:
HNO2 + 3H2 = NH3+ 2H2O
2NH3 + H2SO4 = (NH4)2SO4.
Аммиак вытесняется из сульфата аммония в отгонной колбе щелочью и вновь связывается кислотой в приемнике.
(NH4)2SO4 + 2NaOH = Na2SO4 + 2NH4OH;
2NH4OH= 2NH3 + 2H2O;
2NH3 + H2SO4 = (NH4)2SO4.
Использование результатов анализа.Полученные данные по содержанию легкогидролизуемого азота в почве позволяют оценить обеспеченность почвы подвижным азотом и ориентировочно прогнозировать эффективность азотных удобрений.
Дата добавления: 2021-01-11; просмотров: 716;











