Атом водорода в квантовой механике.
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия He+, двукратно ионизированного лития Li++ и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Ze (для атома водорода Z = 1) равна:
U(r) = 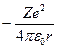 (3.1)
(3.1)
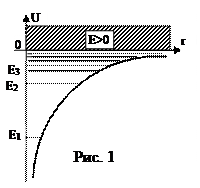 где r – расстояние между электроном и ядром. Графически функция изображена на рис. 1. U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
где r – расстояние между электроном и ядром. Графически функция изображена на рис. 1. U(r) с уменьшением r (при приближении электрона к ядру) неограниченно убывает.
Состояние электрона в атоме водорода описывается волновой функцией y, удовлетворяющей стационарному уравнению Шредингера, учитывающему значение (3.1). В том случае, когда функция U = U(x, y, z) не зависит явно от времени и имеет смысл потенциальной энергии, уравнение Шредингера может быть представлено в виде произведения двух функций, одна из которых есть функция только координат, другая – только времени, причем зависимость от времени выражается множителем 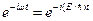 , так что
, так что
Y(x, y, z, t) = y(x, y, z) 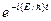 (3.2),
(3.2),
где Е – полная энергия частицы, постоянная в случае стационарного поля. Подставляя уравнение (3.2) в уравнение Шредингера 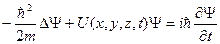 , получим:
, получим:
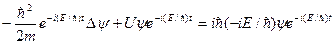 ,
,
Откуда после деления на общий множитель 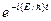 и соответствующих преобразований придем к уравнению, определяющему функцию y:
и соответствующих преобразований придем к уравнению, определяющему функцию y:
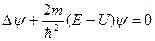 (3.3)
(3.3)
С учетом (3.1) соотношение (3.3) запишется в виде:
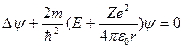 (3.4),
(3.4),
где m – масса электрона, Е – полная энергия электрона в атоме. Так как поле, в котором движется электрон, является центрально-симметричным, то для решения уравнения (3.4) обычно используют сферическую систему координат. Не вдаваясь в математическое решение этой задачи, ограничимся рассмотрением важнейших результатов, которые из него следуют, пояснив их физический смысл.
1. Энергия. В теории дифференциальных уравнений доказывается, что уравнения типа (3.4) имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции y, только при собственных значениях энергии:
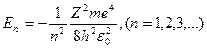 (3.5),
(3.5),
т.е. для дискретного набора отрицательных значений энергии.
Таким образом, решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения показаны на рис. 1 в виде горизонтальных прямых. Самый нижний уровень Е1, отвечающий минимальной возможной энергии – основной, все остальные – возбужденные. При Е<0 движение электрона является связанным – он находится внутри гиперболической «потенциальной ямы». Из рис. 1 следует, что по мере роста главного квантового числа n энергетические уровни располагаются теснее и при n = ¥ E¥ = 0. При Е>0 движение электрона является свободным; область непрерывного спектра Е>0 соответствует ионизированному атому. Энергия ионизации атома водорода равна 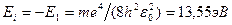 .
.
Выражение (3.5) совпадает с формулой, полученной Бором для энергии атома водорода. Однако, если Бору пришлось вводить дополнительные гипотезы (постулаты), то в квантовой механике дискретные значения энергии, являясь следствием самой теории, вытекают непосредственно из решения уравнения Шредингера.
2. Квантовые числа. В квантовой механике доказывается, что уравнению Шредингера (3.4) удовлетворяют собственные функции ynlm (r, q, j), определяемые тремя квантовыми числами: главным n, орбитальным l и магнитным m.
Главное квантовое число n, согласно (3.5), определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения начиная с единицы: n = 1, 2, 3, …
Из решения уравнения Шредингера вытекает, что момент импульса (механический орбитальный момент) электрона квантуется, т. е. не может быть произвольным, а принимает дискретные значения, определяемые формулой
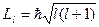 (3.6),
(3.6),
где l – орбитальное квантовое число, которое при заданном n принимает значения
l = 0, 1, …, (n – 1) (3.7),
т. е. всего n значений, и определяет момент импульса электрона в атоме.
Из решения уравнения Шредингера следует также, что вектор Ll момента импульса электрона может иметь лишь такие ориентации в пространстве, при которых его проекция Llz на направление z внешнего магнитного поля принимает квантованные значения, кратные 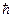 :
:
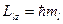 (3.8),
(3.8),
где ml – магнитное квантовое число, которое при заданном l может принимать значения
ml = 0, ±1, ±2, …, ±l (3.9),
т.е. всего 2l+1 значений. Таким образом, магнитное квантовое число ml определяет проекцию момента импульса электрона на заданное направление, причем вектор момента импульса электрона в атоме может иметь в пространстве 2l+1 ориентаций.
Наличие квантового числа ml должно привести в магнитном поле к расщеплению уровня с главным квантовым числом n на 2l+1 подуровней. Соответственно в спектре атома должно наблюдаться расщепление спектральных линий. В 1896 году голландским физиком П. Зееманом был открыт эффект расщепления уровней энергии и спектральных линий натрия в магнитном поле. Он проводил опыт с парами натрия. Под действием магнитного поля уровни энергии расщепляются на зеемановские подуровни; при переходах между подуровнями уровней Еi и Ek вместо одной спектральной линии появляется несколько поляризованных компонент. Различают простой или нормальный эффект Зеемана, когда из одиночной спектральной линии появляется триплет, а также существует аномальный или сложный эффект Зеемана, при котором наблюдается сложная картина расщепления. Исследование картины Зеемановского расщепления важно для изучения тонкой структуры атомов. Наряду с квантовыми переходами между зеемановскими подуровнями, принадлежащими различным уровням энергии, можно наблюдать магнитные квантовые переходы между подуровнями одного уровня энергии. Такие переходы происходят под действием излучения с частотами, лежащими, как правило, в СВЧ – диапазоне электромагнитных волн. Это приводит к эффекту избирательного поглощения радиоволн в парамагнитных веществах, помещенных в магнитное поле, - к электронному парамагнитному резонансу. На основе этого эффекта созданы устройства квантовой электроники, в т. ч. Приборы для измерения слабых магнитных полей. Эффект Зеемана наблюдается и в молекулярных спектрах, однако его наблюдение и расшифровка представляют большие трудности вследствие сложной картины расщепления и перекрытия в них спектральных полос.
Расщепление уровней энергии во внешнем электрическом поле называется эффектом Штарка. Был открыт в 1913 году немецким физиком Й. Штарком, является результатом сдвига и расщепления на подуровни уровней энергии под действием электрического поля. Эффект Штарка получил объяснение на основе квантовой механики. Атом, находясь в состоянии с определенной энергией, приобретает АО внешнем электрическом поле дополнительную энергию вследствие поляризуемости его электронной оболочки и возникновения индуцированного дипольного момента. Уровень энергии при этом смещается. Различные состояния вырожденного уровня энергии могут приобретать разные дополнительные энергии. В результате вырожденный уровень расщепляется на штарковские подуровни, число которых равно числу различных значений дополнительных энергий.
Хотя энергия электрона (3.5) зависит только от главного квантового числа, но каждому собственному значению энергии En (кроме Е1) соответствует несколько собственных функций ynlm , отличающихся значением l и ml. Следовательно, атом водорода может иметь одно и то же значение энергии, находясь в нескольких различных состояниях. Так как при данном n орбитальное квантовое число l может изменяться от 0 до n – 1 (3.7), а каждому значению l соответствует 2l + 1 различных значений ml (3.9), то число различных состояний, соответствующих данному n равно
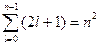 . (3.10)
. (3.10)
Квантовые числа и их значения являются следствием решений уравнений Шредингера и условий однозначности, непрерывности и конечности, налагаемых на волновую функцию y. Кроме того, так как при движении электрона в атоме существенны волновые свойства электрона, то квантовая механика вообще отказывается от классического представления об электронных орбитах. Согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция, квадрат модуля которой определяет вероятность обнаружения электрона в единице объема.
Вероятность обнаружения электрона в различных частях атома различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность (густота) которого характеризует вероятность нахождения электрона в различных точках объема атома. Квантовые числа n и l характеризуют размер и форму электронного облака, а квантовое число ml характеризует ориентацию электронного облака в пространстве.
В атомной физике состояние электрона, характеризующееся квантовыми числами l = 0 называют s-состоянием, l = 1 – p-состоянием, l = 2 – d-состоянием, l = 3 – f-состоянием и т. д. Значение главного квантового числа указывается перед условным обозначением орбитального квантового числа.
3. Спектр. Квантовые числа n, l и ml позволяют более полно описать спектр испускания (поглощения) атома водорода, полученный в теории Бора.
В квантовой механике вводятся правила отбора, ограничивающие число возможных переходов электронов в атоме, связанных с испусканием и поглощением света. Теоретически доказано и экспериментально подтверждено, что для дипольного излучения электрона, движущегося в центрально-симметричном поле ядра, могут осуществляться только такие переходы, для которых: 1) изменение орбитального квантового числа удовлетворяет условию:
Dl = ±1 (3.11)
2) изменение магнитного квантового числа удовлетворяет условию:
Dml = 0, ±1.
В оптических спектрах указанные правила отбора в основном выполняются. Однако в принципе могут наблюдаться и слабые «запрещенные» линии, например возникающие при переходах с Dl =2. Появление этих линий объясняется тем, что строгая теория, запрещающая дипольные переходы, разрешает переходы, соответствующие излучению более сложных систем зарядов, например, квадруполей. Вероятность же квадрупольных переходов (переходы с Dl =2) во много раз меньше вероятности дипольных переходов, поэтому «запрещенные» линии и являются слабыми.
Дата добавления: 2020-12-11; просмотров: 665;











