ПРИМЕРЫ ЭЛЕКТРОЛИЗА
Rb2SO4  2Rb++ SO4–2 2Rb++ SO4–2
| |||
| jо | К (–): Rb+, H2O –2.93 < –0.41 | jо | А (+): SO4–2, H2O 2.05 > 1.23 |
| 2H2O + 2ē → 2OH– + H2↑ процесс происходит непосредственно на электроде и называется первичным. В растворе происходит вторичный процесс: Rb+ + OH– → RbOH | 2H2O – 4ē → 4H+ + O2↑ |
Электролиз с растворимым анодом
AgNO3  Ag+ + NO3– Ag+ + NO3–
| |||
| jо | К (–): Ag+, H2O 0.8 > –0.41 | jо | А (+): (Ag) NO3–, H2O 0.8 < 2.0 > 1.23 |
| Ag+ + 1ē → Ag | Ag – 1ē → Ag+ |
Законы электролиза
Количественная сторона электролиза описывается законами Фарадея.
| I закон Фарадея | Масса вещества, выделившегося на электроде при электролизе, прямо пропорциональна количеству прошедшего через раствор электричества. |
m = К×Q
где m – количество вещества (г),
К – электрохимический эквивалент (г/Кулон),
Q – количество прошедшего электричества (Кл).
Электрохимический эквивалент показывает массу образующегося вещества при пропускании 1Кл электричества.
К= 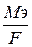
где Мэ – эквивалентная масса (г/моль),
F – число Фарадея (96500 Кл/моль).
Q = I×t
где I – сила тока (Ампер),
t – время (сек).
m = 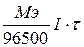
для газов: 
| II закон Фарадея | Одинаковые количества электричества выделяют при электролизе на электродах эквивалентные количества веществ При этом для образования 1 эквивалента вещества требуется 1 Фарадей электричества. m1 : m2 :… : mn = Э1 : Э2 : … : Эn где Э – химические эквиваленты веществ. |
Другими словами, эквивалентное количество некоторого вещества А, выделившееся на электроде в процессе электролиза, определяется, как:

Причём эквивалентные количества веществ, образующихся при протекании одного процесса электролиза, одинаковы, поскольку одинаково количество прошедшего через электроды и сам раствор электричества. По сути, это следствие из закона эквивалентов для процесса электролиза.
Пример. Ток силой 3А проходя через раствор хлорида цинка за 60 минут выделяет из раствора 3,6г металла. Найти эквивалентную массу металла? Найти массу или объем выделившегося вещества на аноде?
Решение. Схему электролиза хлорида цинка мы записали выше. На катоде протекают совместно два процесса, восстановление воды и металла – цинка, но по условию задачи происходит восстановление цинка. На аноде идет окисление хлора с образованием газа, а следовательно расчет будем вести для объема выделяющегося газа – хлора.
Для расчета эквивалентной массы воспользуемсяI законом Фарадея mZn = 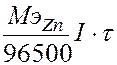 Þ
Þ 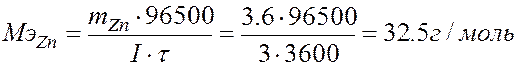
Для расчета объема газа выделившегося на аноде используем II закон Фарадея 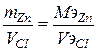 ,
, 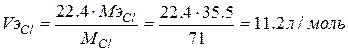 ,
, 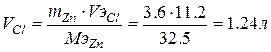
Дата добавления: 2020-12-11; просмотров: 574;











