Электролиз водного раствора
При электролизе водного раствора соли, в растворе кроме гидратированных ионов металла и анионов кислотного остатка, находятся также и молекулы воды и ионы водорода и гидроксо-анионы, продукты диссоциации воды. Поэтому при рассмотрении реакций на электродах необходимо учитывать возможность участия молекул воды в электролизе.
Для описания процессов, протекающих при электролизе водных растворов солей, существует ряд правил:
2. ПОСЛЕДОВАТЕЛЬНОСТЬ РАЗРЯДКИ ИОНОВ НА КАТОДЕ
Общий принцип, описывающий последовательность (очередность) процессов, протекающих на катоде: на катоде в первую очередь разряжается (восстанавливается) ион металла, имеющей наибольший потенциал.
1. Катионы металлов, имеющих малую величину стандартного электродного потенциала (от Li+ до Al3+ включительно), не восстанавливаются на катоде, вместо них восстанавливается вода.
2. Катионы металлов, имеющих стандартный потенциал меньший, чем у водорода, но больший, чем у алюминия (от Al3+ до H+) при электролизе на катоде восстанавливаются одновременно с молекулами воды. Восстановительный потенциал воды, подсчитанный по формуле Нернста, в зависимости от pH среды может иметь значения от (-0,059) до (-0,826) В. Этим объясняется одновременное восстановление водорода с восстановлением некоторых металлов, указанных выше.
3. Катионы металлов, имеющих стандартный потенциал больше, чем у водорода (от Cu2+ до Au3+), при электролизе практически полностью восстанавливается на катоде. Если электролит содержит катионы различных металлов, то при электролизе выделение их на катоде протекает в порядке уменьшения алгебраической величины потенциала соответствующего металла. Так из смеси катионов Ag+, Cu2+, Fe2+ сначала восстанавливаются катионы серебра E0Ag =0,8В, затем катионы меди E0Cu =0,34В и последними – катионы железа E0Fe = -0,44В.
| Металл jо,В | Процесс восстановления |
| Li … Al | 2H2O + 2ē → 2OH– + H2↑ jо = – 0.83B – в нейтральной среде 2H+ + 2ē → H2↑ – в кислой среде |
| Mn … Pb | Men+ + nē 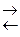 Me
2H2O + 2ē → 2OH– + H2↑
совместное восстановление металла и воды Me
2H2O + 2ē → 2OH– + H2↑
совместное восстановление металла и воды
|
| Cu … Au | Men+ + nē 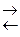 Me Me
|
ПОСЛЕДОВАТЕЛЬНОСТЬ РАЗРЯДКИ ИОНОВ НА АНОДЕ
На аноде протекают реакции окисления восстановителей, поэтому в первую очередь на аноде должны окисляться более сильные восстановители – вещества, имеющие наименьший потенциал.
Процессы на аноде зависят от материала анода и природы аниона. Электроды бывают инертные (графитовые, платиновые) и растворимые.
Для инертных электродов:
Если водный раствор содержит анионы бескислородных кислот, то в первую очередь окисляться будут эти анионы, кроме иона фтора, который в водных растворах не разряжается.
Анионы кислородсодержащих кислот из водных растворов не окисляются. В этом случае окисляются молекулы воды.
Для растворимых электродов – происходит окисление материала самого электрода, в результате чего анод разрушается.
| Анод | Ас–m | |
| бескислородных кислот | кислородсодержащих кислот | |
| Растворимый | Me – nē 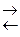 Men+ Men+
| |
| Инертный | Ас–m – mē 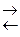 Асо
(кроме F–) Асо
(кроме F–)
| В кислой и нейтральной среде: 2H2O – 4ē → 4H+ + O2↑ jо = – 1,229B В щелочной среде: 4OH– – 4ē → 2H2O + O2↑ jо = – 0.401B |
Дата добавления: 2020-12-11; просмотров: 492;











