Примеры решения задач. Способы выражения концентрации растворов
Способы выражения концентрации растворов
1. Какова массовая доля раствора, полученного растворением 7,5 г хлорида калия в 42,5 г воды?
Решение:
 ω 0 = mв* 100
ω 0 = mв* 100
mр
ω 0 = 7,5 * 100 = 15%
7,5+42,5
2. Какова молярность 62%-ного раствора серной кислоты плотностью 1,52?
Решение. Записываем выражение процентной и молярной концентраций:
ω = mb * 100, См = mв * 1000

 V*d V*M
V*d V*M
Масса вещества при изменении способа выражения концентрации остается неизменной. Выразим из этих формул:
mв = ω * V *d , mв = C * V * M
100 1000
Приравниваем правые части полученных выражений:
ω * V *d = C * V * M
100 1000
Решаем уравнение относительно См:
См = ω* V *d *1000 = ω * d * 10 = 62*1,52*10 = 9,6 м
C * V * M *100 M 98
Аналогично решаются все задачи на переход от одного способа выражения концентрации к другому.
3. До какого объема нужно разбавить 15мл 14%-ного раствора нитрата калия плотностью 1,09 г/мл, чтобы получить 0,5 н. раствора?
Решение. Характеристику раствора процентной концентрации обозначаем индексом 1, а нормальные концентрации - индексом 2. Записываем выражение для концентраций обоих растворов:
ω 0 = mb1 * 100, СN = mb2 * 100
V1*d Э * V2
выражаем из этих формул:
mB1= ω V1d , mB2=CNЭv2
100 1000
приравниваем правые части полученных выражений:
ω V1d =CNЭV2
100 1000
решаем уравнение относительно V2:
V2= ω V110=14*1,09*15*10=45,3мл
CNЭ 0,5*101
1.Cколько граммов 50%-ного раствора азотной кислоты нужно прилить к 250мл воды, чтобы получить 12%-ный раствор?
Решение. Задачу можно решить двумя способами: по диагональной схеме и по закону эквивалентов.
Первый способ. Записываем в верхнем левом углу воображаемого квадрата число наибольшей концентрации – 50, в левом нижнем – 0, в центре – число заданной концентрации – 12. Вычитаем по диагонали из больших чисел в меньшие. Ответом являются числа, противоположные исходным на концах диагоналей
50 12 на 38 г воды требуется 12г 50% раствора
\ / на 250 г воды – х г.
/ \ х=250*12/38=78,9г
0 38
Второй способ. Растворы разной концентрации реагируют между собой в объемах, обратно пропорциональных их концентрациям:
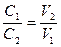
Зная концентрации реагирующих растворов и объем одного из них, можно определить объем другого раствора. Характеристики раствора большей концентрации обозначим индексом 1, меньшей - индексом 2.
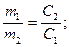
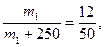
Способы вычисления рН растворов
рН =- lg[Н+]; рОН = - lg[ОН–];
рН + рОН = 14
1. Bычисление рН сильных электролитов.
Пример 1. вычислить рН 0,002М раствора HCL.
Решение. HCl – сильный электролит, т.е. диссоциирует в водном растворе полностью. Поэтому HCl→H++Cl¯ и концентрация ионов водорода будет равна концентрации самой кислоты, т.е. [Н+]=0,002M.
рН= - lg[Н+]=- lg0,002=- lg2*10–3= - (lg2+ lg10–3)=-(0,30-3)=3-0,3=2,70
Пример 2.
Вычислить рН 0,01М раствора Ва(ОН)2
Решение. Ва(ОН)2 – сильный электролит, Ва(ОН)2→Ва²++2ОН¯
Концентрация ионов гидроксила будет равна 0,02М, так как при диссоциации одной молекулы получается два иона гидроксила.
рОН = - lg[ОН–]=- lg0,02=- lg2*10–2=2-0,30=1,70
рН=14-1,70=12,13
1.Вычисление рН слабых электролитов.
Пример 1. Вычислить рН 0,1М раствора уксусной кислоты. Кд = 2*10‾5
Решение. СН3СООН – слабый электролит, и поэтому [Н+] ≠ С кислоты.
СН3СООН = H+СН3СОО‾; применив 3ДМ, получаем
Кд = [Н+][ СН3СОО‾]
[СН3СООН]
Так как при диссоциации получаются равные концентрации
[Н+] и [ СН3СОО‾], можно записать [Н+]²
 Кд =
Кд =
[ СН3СООН  ]
]
Учитывая, что слабый электролит диссоциирует менее 5%, можно считать [СН3СООН] = Ск, т.е. равновесную концентрацию кислоты можно считать исходной [Н+]² = Кд * Ск,
[Н+] = 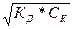 =
= 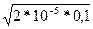 =
= 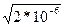 = 1,41*10‾³ М;
= 1,41*10‾³ М;
рН = -lg[Н+] = - lg1,41*10‾³ = 3 – lg0,15 = 2,85.
1.Вычисление рН буферных растворов.
Пример 1. Вычислить рН раствора, полученного сливанием 20 мл 0,1 н. раствора муравьиной кислоты и 15 мл 0,1 н. раствора гидрата окиси калия.
Решение.
НСООН + КОН = НСООК + Н2О
По закону эквивалентов:
Nк * Vк = Nщ * Vщ
На 15 мл 0,1 н. раствора гидроксида калия потребуется 15 мл 0,1 н. раствора муравьиной кислоты; таким образом, получается 15 мл 0,1 н. раствора соли НСООК (без учета разбавления) и остается 5 мл 0,1 н. раствора кислоты. В конечном счёте, имеем в растворе слабую кислоту и её соль, т.е. буферный раствор.
НСООН↔H++HCOO‾
Кд = [Н+][ НСОО‾]
 [НСООН]
[НСООН]
В данном случае [НСОО‾] будет практически равен концентрации полученной соли. Кд= 2*10‾4.
[Н+]= Кд = 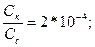
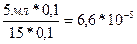
рН = lg6,6*10‾5=5 - lg6,6=5-0,82=4,18.
ГИДРОЛИЗ СОЛЕЙ
Процесс гидролиза количественно может быть охарактеризован с помощью двух величин: степени гидролиза (h) и константы гидролиза (Kr).
Степенью гидролиза называется отношение числа молекул, подвергшихся гидролизу, к общему числу растворенных молекул:
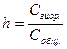 ,
,
где Cгидр. – число молекул, подвергшихся гидролизу;
Собщ. – общее число растворенных молекул.
Степень гидролиза выражается в долях единицы или в процентах. Для солей, гидролизующихся по катиону или аниону, степень гидролиза может быть вычислена по формуле:
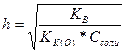
Для солей, гидролизующихся и по катиону и по аниону,
h = Kв

 1-h Кк * Kо ,
1-h Кк * Kо ,
где Кк константа диссоциации образовавшейся кислоты ,
Ко - константа диссоциации образовавшегося основания.
Если степень гидролиза мала (h << 1 ), то знаменатель левой части равенства можно приравнять к единице, т.е.
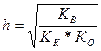 .
.
Степень гидролиза зависит от следующих факторов: 1) природы соли; 2) температуры раствора; 3) концентрации раствора. Влияние природы соли проявляется через константу диссоциации слабого электролита; чем меньше константа диссоциации, тем больше степень гидролиза. Влияние температуры раствора проявляется через ионное произведение воды и, следовательно, гидролиз усиливается.
Разбавление раствора (уменьшение концентрации) также приводит к усилению гидролиза солей, образованным слабым основанием или слабой кислотой. Степень гидролиза солей, образованных слабой кислотой и слабым основанием, от концентрации не зависит. Каждая ступень гидролиза характеризуется своим значением степени гидролиза.
Константа гидролиза определяет состояние химического равновесия в растворе гидролизованной соли. Для солей, гидролизующихся по катиону или по аниону, константа гидролиза равна :
Kr = Kв
 Kк(o)
Kк(o)
Для солей, гидролизующихся и по катиону, и по аниону :
Kr = Kв
 Кo * Kк
Кo * Kк
Следовательно, чем слабее электролит образуется в результате гидролиза, тем полнее протекает гидролиз.
рН растворов солей, подвергающихся гидролизу, полностью определяется их степенью гидролиза, а степень гидролиза, в свою очередь, находится в прямой зависимости от значений констант гидролиза, рН растворов солей слабых оснований и сильных кислот :
pH = 7 - ½ pКo - ½ lgCc,
где pКo = - lgКo - силовой показатель основания.
рН растворов солей слабых кислот и сильных оснований :
pH = 7 + ½ pКк + ½ lgCc
здесь pКк = - lgКк - силовой показатель кислоты.
рН растворов солей слабых оснований и слабых кислот:
pH = 7 + ½ pКк - ½ pКo
1.Какая соль NaCN, NaNO3, NaClO, NaSCN - гидролизуется в большей степени и почему?
Решение. Все соли образованы сильным основанием и слабыми кислотами:
цианистоводородной – К = 6 * 10‾10
азотистой – К = 4 * 10‾4
хлорноватистой – К = 3 * 10‾8
роданистоводородной – 1 * 10 ‾1
Для сравнения констант гидролиза этих солей подставим приведенные значения в уравнения:
 Kr = Kв
Kr = Kв
Kк
Определяющей величиной является Кг, она самая меньшая у цианистоводородной кислоты. Таким образом, в большей степени гидролизуется роданид натрия (NaSCN), так как эта соль образована самой слабой кислотой из приведенных в этом примере.
2.Вычислить степень и константу гидролиза в 0,1 М растворе карбоната калия.
Решение. Карбонат калия – соль, образованная сильным основанием и слабой кислотой ( К1 = 5 * 10‾ 7 ; К2 = 5 * 10‾11):
СО3²‾+ НОН = НСО3‾ + ОН‾;
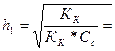
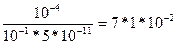 , или 7,1%
, или 7,1%
Для вычисления степени гидролиза используем константу диссоциации слабой кислоты - НСО3‾, т.е. константу диссоциации угольной кислоты по II ступени – К2
 Kr = Kв = 10‾14= 2 *10‾4.
Kr = Kв = 10‾14= 2 *10‾4.
Kк 5 * 10‾11
3. Вычислить рН 0,01 М раствора хлорида аммония.
Решение. Данная соль образована слабым основанием и сильной кислотой:
NH4 + HOH = NH4OH + H+
pH = 7 - ½ pК0 - ½ lgCc = 7 - ½ 4,7 - ½lg10‾² = 5,56
pК0 = - lgК0 = - lg2 * 10‾5 = 5 – 0,3 = 4,7
Реакции окисления-восстановления
1.Вычислить величину электродного потенциала серебра в 0,01М растворе сульфата серебра.
Решение:AgSO4→2Ag++SO4²‾ , следовательно, молярная концентрация ионов серебра равна 0,02 г ион/л:
Е=Е0+0,058 lgaМеn+.
n
Е0 - стандартный электродный потенциал серебра находят из таблицы, для полуреакции Ag++e→Ag0, Е0=0,799 в, тогда:
Е=0,799+0,058 lg 0,02=0,789 в
2.Закончить уравнение Zn + KMnO4 + H2SO4 →……… и подсчитать сумму коэффициентов.
Решение: находим в данной реакции окислитель (KMnO4) и восстановитель (Zn) и записываем уравнения полуреакции:
Zn-2e→Zn²+ 5
MnO4‾+8H++5e→Mn²++4H2O 2
5Zn+2MnO4‾+ H+→5 Zn²++ Mn²++8H2O
Заканчиваем реакцию в молекулярной форме:
5Zn+2KMnO4+8H2SO4↔5ZnSO4+2MnSO4+K2SO4+8H2O
∑ коэффициентов = 31.
3.Вычислить эквивалент окислителя в п. 2.
Решение: ЭKMnO4=Mв=39+55+64=31,6
5 5
Дата добавления: 2016-09-06; просмотров: 2946;











