Клинические аспекты.
Оценка В-системы иммунитета (гуморальный иммунитет).
Для оценки В-системы иммунитета применяют несколько методов.
Определение В-лимфоцитов в крови. Используют три свойства лимфоцитов этого типа.
Наличиерецепторов к комплементу дает возможность подсчитать так называемые комплементарные розетки, т.е. лимфоциты, образующие розетки с эритроцитами, несущими на своей поверхности комплекс антитело — комплемент (ЕАС-розеткообразование). К розеткообразованию способны не только лимфоциты, но и гранулоциты. И. Вонг, А. Уилсон в 1975 г. описали технику постановки ЕА- и ЕАС-розеткообразования нейтрофилами, что доказало наличие у этих клеток Fс-рецепторов. В 1976 г. И. В. Петрова и соавт. описали способность нейтрофилов к спонтанному розеткообразованию с эритроцитами барана и было показано, что эта субпопуляция нейтрофилов резко возрастает при иммунодепрессивной терапии. По аналогии с лимфо- цитами нейтрофилы делят на спонтанные розеткообразующие клетки, комплементарные розеткообразующие клетки и нулевые. У здоровых людей спонтанных розеткообразующих нейтрофилов имеется от 25 до 35%, а комплементарных — от 14 до 20%.
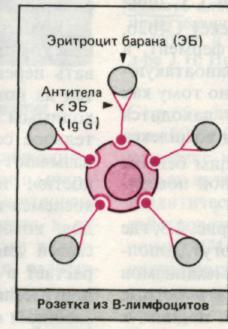
рис. 1. Розеткообразование В- клеток.
Наличие у В-лимфоцитов рецепторов к Fс-фрагменту иммуноглобулинов приводит к тому, что они адсорбируют на себе агрегированный γ-глобулин. Выявить В-лимфоциты можно с помощью флюоресцентного или радиографического метода, используя меченые агрегаты γ-глобулинов. Человеческие В-лимфоциты образуют розетки с мышиными эритроцитами. Наконец, с помощью иммунофлюоресцентного метода Кунса, применяя антиглобулиновые сыворотки, можно обнаружить и подсчитать все лимфоциты, несущие иммуноглобулиновые детерминанты, т. е. В-лимфоциты. При этом можно провести дифференцированный подсчет клеток, несущих IgМ-, IgG или 1gА-детерминанты. Так же необходимо определять не только процент В-клеток, но и их абсолютное количество в 1 мкл крови.
Определение в крови уровня иммуноглобулинов. Проводят определение суммарной концентрации иммуноглобулинов и количество иммуноглобулинов разных классов. Первое осуществляется методом высаливания сульфа-том цинка с последующей турбидиметрической оценкой, электрофорезом или иммуноэлектрофорезом. Нормальный уровень суммарных иммуноглобулинов у человека составляет от 10 до 20 г/л. Определение количества IgМ, IgG и IgА чаще всего осуществляется методом радиальной иммунодиффузии по Манчини. IgЕ определяется радиоиммунологическим методом. Верхняя граница нормы составляет 0,0005 г/л.
Определение наличия и уровня изогемагтлютининов в сыворотке крови, а также естественных (нормальных) антител к широко распространенным бактериям и вирусам. В качестве антигенов можно использовать кишечную палочку, стафилококковые токсины, вирус герпеса и др. Следует иметь в виду, что ά- и β-изогемагглютинины относятся к IgМ.
Исследование антителогенеза (первичного и вторичного ответа) после акти-вной иммунизации несколькими убитыми вакцинами. Применяют коклюшную и убитую полиомиелитную вакцины, дифтерийный и столбнячный анатоксины, полисахаридные антигены, выделенные из пневмококков, менингококков и бактерий кишечной группы. Необходимость использования нескольких антигенов связана с генетически детерминированной конкретностью иммунного ответа. Получение низкого иммунного ответа на какой-то один антиген может оказаться результатом того, что данный индивидуум относится к низкоотвечающему на данный антиген генотипу. Реакция на другие антигены может быть нормальной. Вот почему диагноз функциональной неполноценности В-системы можно поставить только при угнетении иммунного ответа на несколько разных антигенов.
Исследование катаболизма иммуноглобулинов в организме. В кровь вводят меченый препарат человеческого иммуноглобулина. Клиренс метки из крови и ее накопление в моче и испражнениях дают возможность определить период полужизни иммуноглобулина. В норме период полужизни IgG равен 24 дням. При экссудативной энтеропатии, нефрозах и некоторых других заболеваниях возникает состояние гиперкатаболизма иммуноглобулинов. Для установления факта избирательного их гиперкатаболизма параллельно определяют период полужизни меченого альбумина.
Биопсия лимфатических узлов, костного мозга, участков слизистой оболочки кишечника. Эту процедуру проводят с целью гистологического обнаружения плазматических клеток, наличия и структуры лимфоидных фолликулов. Кожные реакции, выявляющие гиперчувствительность немедленного типа. К таким пробам относится ШИК-реакция. У людей, иммунизированных против дифтерии, в организме которых содержатся антитела против дифтерийного токсина, внутрикожная инъекция этого токсина не приводит к развитию типичной эритемы.
Стимуляция биосинтеза иммуноглобулинов В-лимфоцитами in vitro. Оценка функциональной активности В-лимфоцитов из крови человека возможна благодаря тому, что некоторые митогены, например митоген лаконоса, обладают способностью вызывать поликлональную стимуляцию В-лимфоцитов. «Валовую» продукцию В-клеток, синтезирующих иммуногло-булины, определяют в культуральной жидкости радиоиммунологическим методом через 7—12 дней культивирования лимфоцитов с митогеном.
рис. 2. Гуморальный иммунный ответ.
В-лимфоциты вырабатывают антитела, помогая распознавать и удалять чужеродные антигены (переносимые бактериями или вирусами). Им помогают циркулирующие в крови Т-лимфоциты и макрофаги.
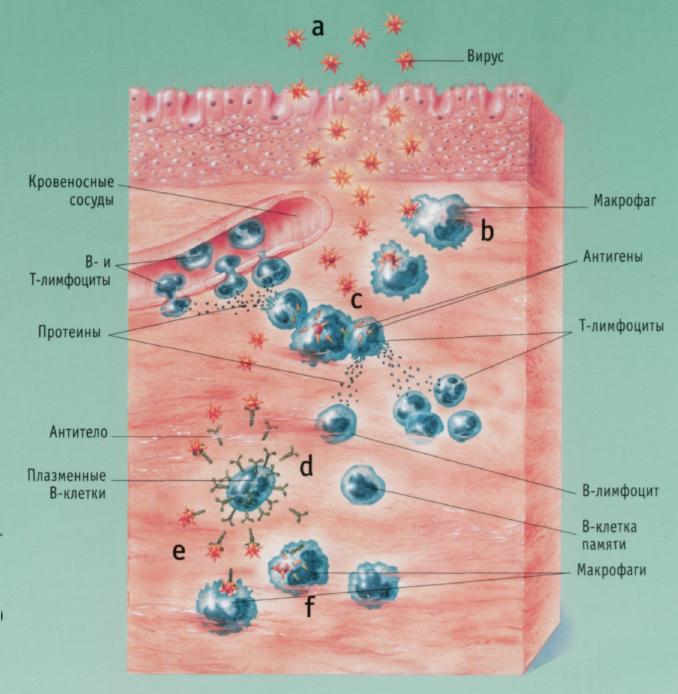
а) Вирусные частицы через поверхностные клетки проникают в ткань и размножаются.
б) Макрофаги пожирают вирусные частицы,
в) Макрофаги передают антигены циркулирующим в крови Т-лимфоцитам. Это приводит к мобилизации дополнительного количества Т- и В-лимфоцитов.
г) В-лимфоциты распадаются на плазматические В-клетки, которые производят антитела, специфичные для проникшего вируса, и В-клетки памяти.
д) Циркулирующие в крови антитела взаимодействуют с вирусными частицами.
е) Макрофаги распознают и пожирают вирусы, защищая организм от инфекций. 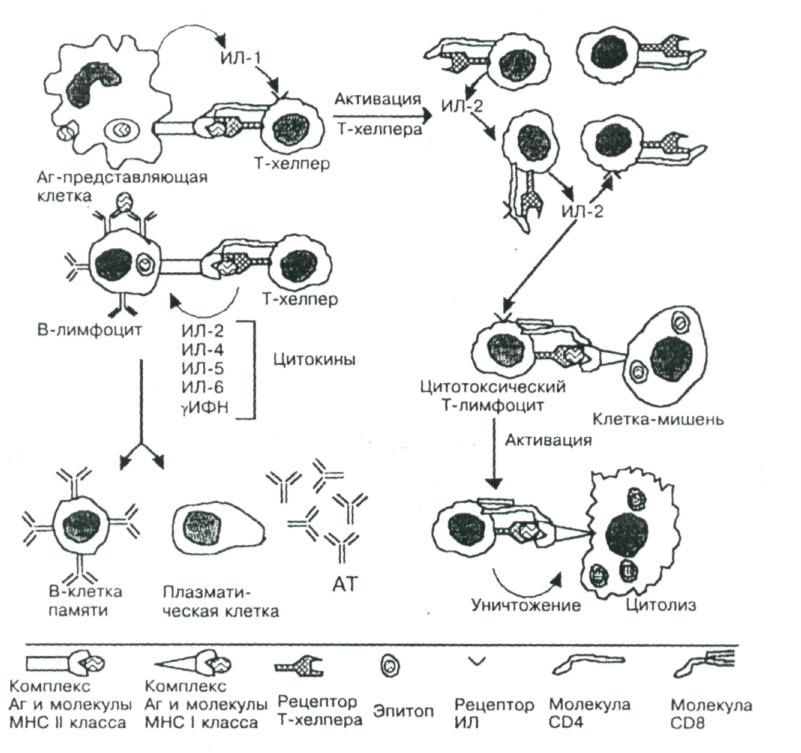
рис.3. Взаимодействие клеток при иммунном ответе.
Рецептор Т-хелпера распознаёт антигенную детерминанту (эпитоп) вместе с молекулой ГКГ 11 класса, выставленные на поверхности Аг-представляющей клетки. В молекулярном взаимодействии участвует дифференцировочный Аг Т-хелпера СD4. В результате подобного взаимодействия Аг- представляющая клетка секретирует ИЛ-1, стимулирующий в Т-хелпере синтез и секрецию ИЛ-2, а также синтез и встраивание в плазматическую мембрану того же Т-хелпера рецепторов ИЛ-2. ИЛ-2 стимулирует пролиферацию Т-хелперов и активирует цитотоксические Т-лимфоциты. Отбор В-лимфоцитов произво-дится при взаимодействии Аг с Fаb -фрагментами Ig М на поверхности этих клеток. Эпитоп этого Аг в комплексе с молекулой ГКГ II класса узнаёт рецептор Т-хелпера, после чего из Т-лимфоцита секретируются цитокины, стимулирующие пролиферацию В-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие АТ против данного Аг. Рецептор цитотоксических Т-лимфоцитов связывается с антигенной детерминантой в комплексе с молекулой ГКГ I класса на поверхности вирус- инфицированной или опухолевой клетки. В молекулярном взаимодействии участвует диффе-ренцировочный Аг цитотоксического Т-лимфоцита СD 8. После связывания молекул взаимодействующих клеток цитотоксический Т-лимфоцит убивает клетку-мишень.
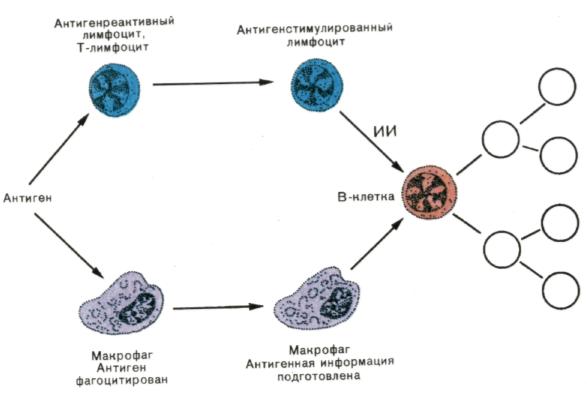
Рис. 5. Трехклеточная система взаимодействия при развитии гуморального иммунного ответа.
В-лимфоцит получает специфическую информацию об антигене от поглотившего чужеродный материал макрофага и неспецифическую — от индуктора иммунопоэза (ИИ), секретируемого Т-лимфоцитом после распознавания антигена. В условиях, когда кооперируют все три типа клеток, развивается полноценный иммунный ответ. Если В-клетка получает только информацию об антигене от макрофага, а помощь со стороны Т-клетки отсутствует, то индуцируется специфическая неотвечаемость — толеран-тность. При действии на В-клетку только ИИ происходит синтез неспецифических иммуноглобулинов.
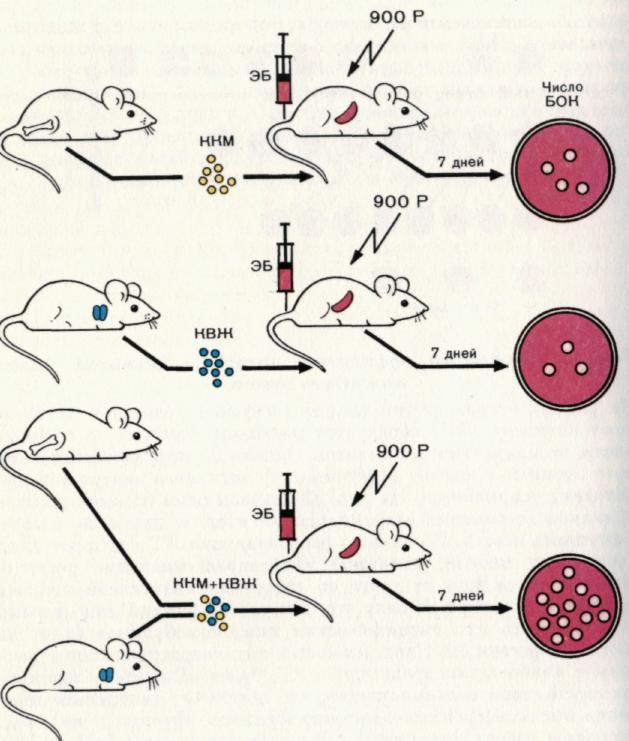
Рис. 6. Взаимодействие между клетками вилочковой железы (источника Т-клеток) и клетками костного мозга (источника В-клеток) при индукции гуморального иммунного ответа.
Гуморальный ответ развивается как комплексный процесс, который включает несколько типов клеток. Введение облученным мышам только клеток костного мозга — ККМ (В-лимфоцитов) или только клеток вилочковой железы — КВЖ (Т-клеток) не обеспечивает развитие иммунного ответа достаточной силы. В то же время введение смеси этих клеток приводит к формированию интенсивной продукции антител к эритроцитам барана. Причем ответ при таком совместном введении клеток значительно выше, чем сумма ответов при раздельном введении клеток различного происхождения. Иначе кооперация различных типов клеток приводит к синергическому эффекту. Ответ оценивали по количеству бляшкообразующих клеток (БОК) в селезенке.
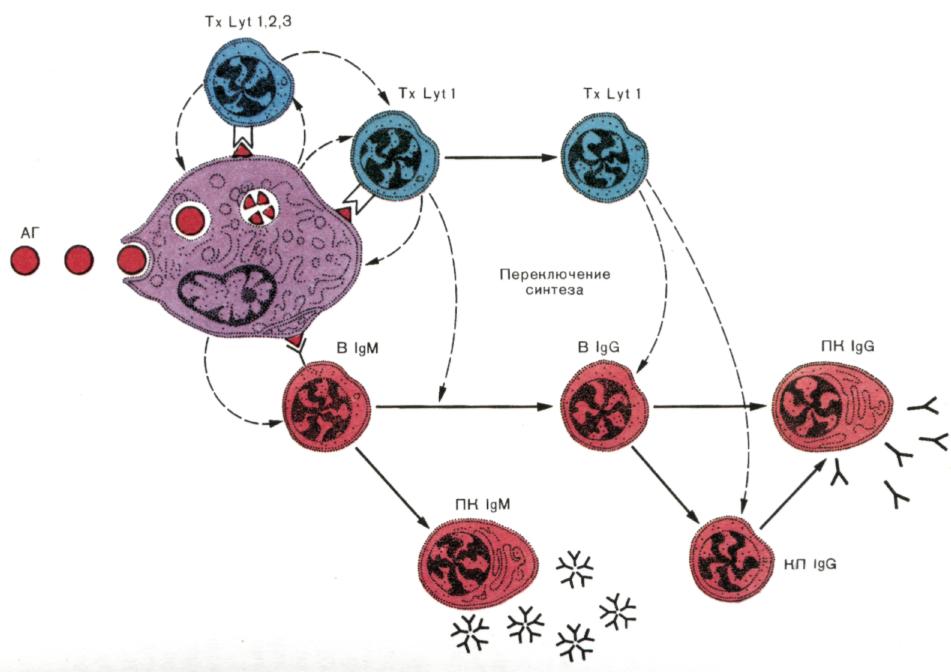
Рис. 7. Развитие гуморального иммунного ответа.
«Суммарная» схема, учитывающая субпопуляции лимфоцитов, которые участвуют в индукции антителогенеза, переключение синтеза IgМ на синтез IgG и создание клеток памяти. Захваченный макрофагами (МФ) антиген (АГ) выводится на клеточную поверхность в иммуногенной форме. В реакцию распознавания АГ вступают «ранние» Т-хелперы с фенотипом, которые способствуют созреванию «поздних» Т-хелперов, помогающих антителопродукции. Развитие первичного IgМ-ответа не требует помощи со стороны Тх Lуt1. Для накопления плазматических клеток, продуцирующих IgМ-антитела (ПК IgМ), очевидно, достаточно простого распознавания АГ на поверхности МФ. Однако помощь Тх Lуt1необходима для внутриклеточного переключения синтеза IgМ на синтез IgG, накопления плазматических клеток, синтезирующих и секретирующих IgG (ПК IgG) и вступления клеток памяти (КП IgG) во вторичный иммунный ответ.
Клеточный иммунный ответ характеризуется пролиферацией коммитированных иммунокомпетентных клеток, реагирующих с Аг в комплексе с молекулой ГКГ I класса на поверхности чужеродных клеток или эндогенными иммуногенами в комплексе с молекулой ГКГ I класса на поверхности собственных вирус- инфицированных и опухолевых клеток. В клеточном иммунном ответе участвует цитотоксический Т-лимфоцит. Цитотоксический Т-лимфоцит (Тс). Предъявленный на поверхности клетки-мишени Аг в комплексе с молекулой ГКГ I класса связывается с рецептором цитотоксического Т-лимфоцита. В этом процессе участвует молекула СD8 клеточной мембраны Тс. Секретируемый Т-хелперами ИЛ-2 стимулирует пролиферацию цитотоксических Т-лимфоцитов. Уничтожение клетки-мишени. Цитотоксический Т-лимфоцит распознаёт клетку-мишень и прикрепляется к ней. В цитоплазме активированного цитотоксического Т-лимфоцита присутствуют мелкие тёмные органеллы, напоминающие запасающие гранулы секреторных клеток. Гранулы концентрируются в той части Т-киллера, которая расположена ближе к месту контакта с клеткой-мишенью. Параллельно происходят переориентация цитоскелета и смещение в эту область комплекса Гольджи, в котором и формируются гранулы. В них содержится цитолитический белок перфорин.
Выделяемые Т-киллером молекулы перфорина полимеризуются в мембране клетки-мишени в присутствии Са2+. Сформированные в плазматической мембране клетки-мишени перфориновые поры пропускают воду и соли, но не молекулы белка. Если полимеризация перфорина произойдет во внеклеточном пространстве или в крови, где в избытке имеется кальций, то полимер не сможет проникнуть в мембрану и убить клетку. Специфическое действие Т-киллера проявляется только как результат тесного контакта между ним и клеткой-мишенью, который достигается за счёт взаимодействия Аг на поверхности жертвы с рецепторами Т-киллера. Сам Т-киллер защищен от цитотокси-ческого действия перфорина. Механизм самозащиты неизвестен. Альтернативный механизм уничтожения клетки-мишени, согласно которому цитотоксические Т-лимфоциты и NK-клетки являются источником сигнала, который запускает уже предсуществующую суицидальную программу в клетке-мишени. Действие этого сигнала усиливают глюкокортикоиды.
Дата добавления: 2016-09-06; просмотров: 2865;











