Металловедение и термическая обработка металлов.
Материаловедение – это наука, изучающая взаимосвязь между составом, строением и свойствами материалов. С развитием техники расширяется ассортимент используемых материалов. Наряду с традиционными, появляются новые материалы, требующиеся в различных областях народного хозяйства и обладающие особыми свойствами. Подобно тому, как 32 буквы алфавита или 7 нотных знаков создают все многообразие языка и музыки, так и элементы таблицы Менделеева позволяют получить неисчислимое множество материалов с разнообразными свойствами. В их числе магнитные, теплопрочные и тугоплавкие, спеченные порошковые материалы, композиционные материалы, ситаллы (стекло – кристаллы или стекло и керамика) и др.
Во все времена технический прогресс всегда был и будет связан с материалами.
Именно с новыми материалами связывают ученые и инженеры решение задач, стоящих перед обществом. Взять, к примеру, управляемую термоядерную реакцию, которая обеспечит человечество энергией на миллионы лет. Сейчас практическая реализация научных идей сдерживается из-за отсутствия мощных сверхпроводящих магнитов. Удастся создать подобные соленоиды, значит осуществится управляемая термоядерная реакция. Нет – решение проблемы века отложится на 10-ти летия. В формуле «технология – материал – технология» заключается одна из важнейших функций материала и его влияние на научно-технический прогресс. Например, титан.
Курс «Материаловедение» включает 2 части. 1 – Материаловедение и термическая обработка металлов; 2 – неметаллические материалы (полимеры, керамика, стекло, резина и т.д.).
Очевидные успехи в создании современных неметаллических материалов должны бы несколько снизить темпы развития некоторых металлургических процессов, но металлы в целом сохранят свое значение как основной материал в машиностроении и в большинстве других отраслей народного хозяйства еще несколько десятилетий. По самым смелым прогнозам, полимеры и композиты уже должны были к 1990 году вытеснить не более 10-ти % черных и около 30% цветных металлов. Для нашей цивилизации металлы останутся незаменивыми, потребность в них будет расти и впредь.
Чтобы изучать материаловедение, необходимо выяснить общее для всех материалов. Для большинства технических материалов характерно кристаллическое строение. Это позволяет с единых позиций рассмотреть закономерности формирования кристаллической структуры и свойств, определяемых природой связи между атомами. Улучшение характеристик уже имеющихся материалов достигается корректировкой химического состава и внешними воздействиями (тепловым, пластическим деформированием). Создаются и принципиально новые материалы.
Металловедение изучает зависимость между составом, строением и свойствами металлов и сплавов и закономерности их изменения под воздействием внешних факторов (тепловых, химических, механических, электромагнитных и радиоактивных).
Впервые осуществление связи между строением стали и ее свойствами было установлено Павлом Петровичем Аносовым (1799-1851г.г.). [Ю. Г. Гуревич «Загадка булатного узора». Знание, 1985, 190 с.]. Имеется в виду секрет булата, основанный на термической обработке.
Основоположником металловедения как науки является Дмитрий Константинович Чернов – русский металлург (1839-1921 гг.). Он показал, что сталь в твердом состоянии при нагреве или охлаждении подвергается фазовым превращениям, вызывающим значительные изменения ее свойств. Д. К. Чернов – основатель современной теории кристаллизации металлов.
Большая роль в развитии металловедения принадлежит н. С. Курнакову (нач. ХХ в.), применившему физико-химические методы анализа для исследования металлов. Им было изучено большое количество систем, построены диаграммы состояния и установлены зависимости между составом, структурой и свойствами различных сплавов.
Кристаллическое строение металлических сплавов и фаз было установлено в начале 20-х годов благодаря широкому использованию рентгеновского анализа, позволившему изучить изменения строения в зависимости от обработки сплава.
Важнейшие исследования в этой области были проведены советскими учеными Г. В. Вульфом, С. С. Штейнбергом, Г. В. Курдюмовым и др. Выполняли их и зарубежные ученые: М. Лауэ и П. Дебай (Германия). У. Г. Брэгг (Англия и др.
В развитие термической обработки большой вклад внесли современные исследователи н. А. Минкевич, Н. Г. Гудцов, А. А. Бочвар.
Металловедение не может не развиваться и в настоящее время. За последние годы созданы новые виды термической и химико-термической обработки стали, разработаны основы легирования стали, созданы коррозионно-стойкие, высокопрочные стали и сплавы, а также стали и сплавы на основе Al, Ti и других металлов. Все более широко применяются редкие металлыи их сплавы.
Металловедение тесно свяхано с другими науками – общетехническими (физхимия, химсопромат) и технологическими (технология конструкционных материалов), специальными.
2. Классификация материалов и требования к ним.
Все материалы, применяемые в машиностроении, целесообразно разделить на 2 основные группы: металлические и неметаллические.
К металлическим относятся металлы и их сплавы. В природе приблизительно 4/5 всех элементов приходится на долю черных и цветных металлов.
Железо и сплавы на его основе (сталь, чугун) принято называть черными металлами. Сюда же можно отнести тугоплавкие металлы (W, V, Mo).
К цветным металлам относятся:
а) легкие металлы (γ < 5 г/см3). Это Mg, Al, Be, Ti (1,74; 2,7; 1,82; 4,54).
б) тяжелые (γ > 5 г/см3) – Cu, Ni, Pb (8,9; 8,9; 11,34).
в) легкоплавкие – Zn, Cd, Hg, Bi, Sn (419,5; 321; -38,9 °С тпл/кр; 271; 232 °С).
г) благородные металлы – Ag, Au, Pt, Pd, Os.
Неметаллические материалы могут быть органического и неорганического происхождения. К органическим относятся полимерные материалы (пластмассы, каучуки, резина), углеграфитные материалы, дерево.
Неорганические материалы подразделяются на:
а) горные породы; б) керамические материалы; в) искусственные плавленые силикатные материалы (стекло, эмали).
Материалы должны обладать необходимой механической прочностью и достаточным запасом пластичности.
Ежегодно 1/3 металлических материалов выходит из строя в результате коррозии, поэтому важным требованием является высокая коррозионная стойкость.
В ряде отраслей техники необходима высокая жаропрочность, т.е. способность материалов сохранять необходимую прочность при работе в области высоких температур.
При низких температурах металлы могут переходить в хрупкое состояние. Для предотвращения этого металл должен обладать стойкостью к хладноломкости.
Во всех случаях учитывается экономическая целесообразность использования того или иного материала. Иногда предъявляются специфические требования, например, определенная степень чистоты.
3. Металлы и их свойства. Металлическая связь.
Известно в настоящее время 80 металлов. Они занимают 4/5 всех клеточек таблицы Менделеева. Металлам характерны следующие свойства:
Высокая тепло - и электропроводимость.
Положительный коэффициент электрического сопротивления. С повышением температуры электрическое сопротивление возрастает. Большое число металлов (примерно 30) обладают сверхпроводимостью. При температуре, близкой к абсолютному 0 электрическое сопротивление этих металлов скачкообразно падает до 0.
Способность испускать электроны при нагреве (термоэлектронная эмиссия).
Отражательная способность, непрозрачность и металлический блеск.
Повышенная способность к пластической деформации. При наличии этих свойств достигается так называемое металлическое состояние вещества.
Металлоиды, в отличие от металлов, как правило, хрупки, не обладают металлическим блеском, характеризуются низкой тепло- и электропроводимостью и отрицательным коэффициентом электрического сопротивления.
Все наиболее характерные свойства металлов объясняются наличием в них легкоподвижных электронов проводимости.
Как известно, атом состоит из положительно заряженного ядра и движущихся вокруг него электронов. Различают внешние (валентные) электроны, связь которых с ядром незначительна и внутренние – более прочно связанные с ядром.
Внешние электроны способны отщепляться от атомов и находится в относительно свободном состоянии, образуя электронный газ. Положительно заряженные ионы стягиваются отрицательно заряженным электронным газом в кристалл.
Атомы в металлах располагаются близко один к другому. Это означает, что наблюдается значительное перекрывание орбиталей внешних электронов и что валентные электроны фактически связаны не с отдельным ядром, а делокализованы по всем атомам металла. Таким образом, металл представляет собой ионно-электронную систему, устойчивость которой определяется электрическим притяжением между положительно заряженными ионами и обобщенными электронами. Такое взаимодействие между ионами и электронным облаком называется металлической связью.
Сила связи в металле определяется силами отталкивания и силами притяжения между ионами и электронами, не имеющими резко выраженного направленного характера.
Атомы или ионы располагаются на таком расстоянии друг от друга, чтобы энергия взаимодействия была минимальной.
Различают 4 типа металлической атомной связи – ионную, ковалентную, полярную и металлическую.
Ионная связь возникает у разнородных атомов, когда какой-либо из них отдает с внешней оболочки, а другой принимает 1 или несколько электронов. Образующиеся при этом положительные и отрицательные ионы с завершенными внешними оболочками благодаря электрическим силам взаимно притягиваются.
Ковалентная связь возникает обычно у одинаковых атомов и осуществляется парами валентных электронов, которые одновременно принадлежат 2-м соседним ионам, находящимся в узлах решетки. Связь имеет резкую направленность и высокую прочность. Этот тип связи характерен для соединений углерода.
Полярная связь возникает вследствие смещения электронной плотности в молекулах к более электроотрицательному атому и появления слабого электрического притяжения.
Приведенные положения позволяют объяснить характерные свойства металла.
Электрическая проводимость – наличием в металле свободных электронов, которые под влиянием разности потенциалов перемещаются от отрицательного полюса к положительному. С повышением температуры усиливаются колебательные движения ионов, что затрудняет прямолинейное движение электронов, в результате чего возрастает электрическое сопротивление.
При низких температурах колебательное движение ионов сильно уменьшается и электропроводимость возрастает. У некоторых металлов в результате упорядоченного движения пар электронов при очень низких температурах (< 200К) электрическая проводимость обращается в ∞ (сверхпроводимость).
Высокая теплопроводимость металлов обусловливается как большой подвижностью свободных электронов, так и колебательными движениями ионов, вследствие чего происходит быстрое выравнивание температуры в массе металла.
Высокая пластичность металла объясняется периодичностью их атомной структуры и ненаправленностью металлической связи. В процессе пластической деформации (ковка, прокатка), т.е. при смещении объемов металла, связь между ионами не нарушается.
Направленность – важнейшее свойство ковалентной связи, определяющее геометрию молекулы. Причина направленности заключается в том, что перекрывание облаков, образующих химическую связь, происходит в направлении набольшей плотности их (наибольшей вытянутости), например, Cl2 ∞∞.
Кристаллы с ковалентной связью хрупки, т.к. при деформации связь нарушается.
4. Кристаллическое строение металлов. Типы кристаллических решеток.
Все металлы и их сплавы – тела кристаллические и, в отличие от аморфных тел с хаотичным расположением атомов, в металлах они расположены закономерно.
Металлы, полученные обычным способом, поликристалличны и состоят из большого числа мелких (10-1 ÷ 10-5 см) различно ориентированных по отношению другш к другу кристаллов, имеющих неправильную форму (вследствие условий кристаллизации) и называемых кристаллитами или зернами.
Гипотеза о закономерности расположения частиц в кристаллах была выдвинута в 1860 году Е. С. Федоровым и доказана в 1912 году м. Лауэ с помощью рентгеноструктурного анализа.
Косвенным доказательством кристалличности строения металлов может служить термический анализ. Если tзатв=f(τ) и для чистых металлов строго постоянна, то график охлаждения вещества будет иметь следующий вид:
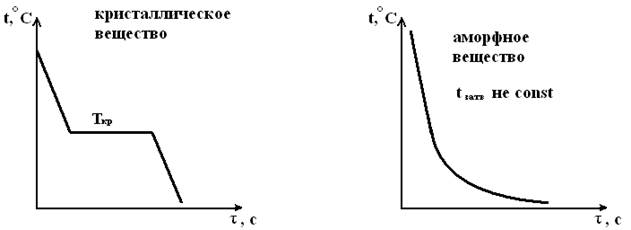
Т.е. закономерности неодинаковы для кристаллических и аморфных веществ.
Переход кристаллического вещества из жидкого состояния в твердое происходит при температуре кристаллизации (Ткр.). Процесс перехода протекает в определенный промежуток времени и сопровождается выделением скрытой теплоты кристаллизации. Поэтому, несмотря на охлаждение металлов, температура в течение данного времени остается неизменной (горизонтальный участок). Скрытая теплота затвердевания компенсирует потерю тепла в пространстве.
Затвердевание аморфного вещества происходит постепенно без резко выраженной границы между жидким и твердым состоянием.
Структура (строение) аморфного вещества характеризуется беспорядочной пространственной сеткой, в узлах которой расположены ионы, атомы или гр. атомов.
Для описания кристаллической структуры веществ пользуются понятием кристаллической решетки.
Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются атомы (ионы), образующие металл.
Для металлов характерны сравнительно простые типы кристаллических решеток с высокой плотностью упаковки атомов. Расположение атомов в кристалле удобно изображить в виде так называемых элементарных кристаллических ячеек. Это наименьший объем кристалла, дающий представление об атомной структуре металла в любом объеме.
Различают:
1. Простая кубическая (на долю одной элементарной ячейки – 1 атом)
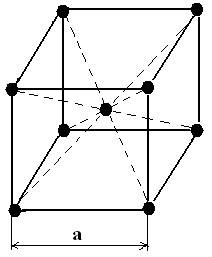
2. Объемноцентрированная (ОЦК) кубическая.
Кубическую решетку определяет длина ребра куба [а] = ангстрем, А
Ао=10-10м=10-8см α-Fe, W, V, Mo
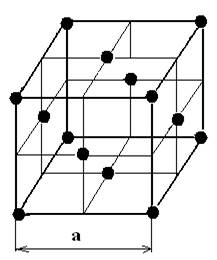
3. Гранецентрированная (ГЦК)
α-Fe, Al, Cu
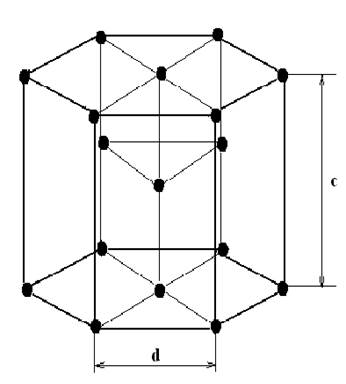
4.Гексагональная плотноупакованная (ГПУ)
Размеры характеризуются const значением c/d=1,633. При иных соотношениех c/d получается неплотноупакованная решетка. Mg, Zn, Re, Os.
Геометрию и плотность упаковки элементарных частиц в кристалле отражают такие понятия, как координационое число (КЧ) и коэффициент компактности (КК). Координационное число определяет число ближайших равноудаленных элементарных частиц.
Коэффициент компактности определяет отношение объема всех элементарных частиц, приходящихся на одну элементарную ячейку, ко всему объему элементарной ячейки.
| Показатели | Тип решетки | |||
| Кубич. | ОЦК | ГЦК | ГПУ | |
| К.Ч. | ||||
| К.К. | 0,52 | 0,68 | 0,74 | 0,74 |
4. Анизотропия свойств кристаллов.
Анизотропия – это векториальность, неодинаковость свойств кристалла в разных кристаллографических направлениях, возникающая в результате упорядоченного расположения атомов (ионов) в пространстве. Различны расстояния между атомами в разных кристаллографических направлениях, различны и свойства, т.к. последние определяются взаимодействием атомов. Наиболее сильно анизотропия проявляется в кристаллах со структурами, обладающими малой симметрией. Анизотропия присуща всем свойствам кристаллов и особенно важна при использовании монокристаллов (т.е. кристаллов, полученных искусственным путем). В природных условиях кристаллические тела, как уже отмечалось, поликристалличны и состоят из множества мелких, различно ориентированных кристаллов. В этом случае анизотропия не проявляется, т.к. среднестатистическое расстояние между атомами по всем направлениям примерно одинаково. В связи с этим поликристаллические тела считают мнимоизотропными.
При обработке поликристаллов давлением кристаллографические плоскости одного индекса (индексы направления – это координаты узла кристаллической решетки, выраженные целыми числами u, υ, ω, в единицах отрезков а, в, с) в различных зернах могут ориентироваться параллельно. Такие поликристаллы называют текстурованными и они подобно монокристаллам, анизотропны. У аморфных тел свойства не зависят о направления.
Дата добавления: 2019-05-21; просмотров: 1412;











