Анализ диаграмм состояния двойных сплавов. Правило фаз. Правило отрезков.
Общие закономерности сосуществования устойчивых фаз могут быть выражены в математической форме согласно правила фаз или закона Гиббса. Правило фаз – это количественная характеристика, выражающая зависимость между степенью свободы системы, количеством фаз и компонентов.
Фазой (Ф) называется однородная часть системы, отделенная от других частей системы поверхностью раздела, при переходе через которую химический состав или структура вещества изменяются скачкообразно.
Компонентами (К) называют вещества (минимальное количество элементов), образующие систему.
Степень свободы или вариантность системы (С) подразумевает число внешних и внутренних факторов (температуры, давления), которые можно изменять без изменения числа фаз в системе.
Если принять число внешних факторов (m)=2 (температура, давление), то правило фаз имеет вид: С=К+2 – Ф. С= К – Ф+2
Правило фаз справедливо только для равновесного состояния. Поскольку все превращения в металлах происходят при постоянном давлении, равном 0,1Мпа, уравнение примет вид: С = К – Ф + 1
Проследим изменение степени свободы для кристаллизации чистого металла (К=1). Когда металл находится в жидком состоянии, С=К-Ф+1=1-1+1=1, С=1, система моновариантна и температуру можно изменять, не изменяя агрегатного состояния.
В момент кристаллизации Ф=2 (твердая и жидкая), С=1-2+1, С=0 (нонвариантная система). Это значит, что 2 фазы находятся в равновесии при строго определенной температуре (Тпл) и она не может быть изменена, пока одна из фаз не пропадет, т.е. система не станет моновариантной (С=1).
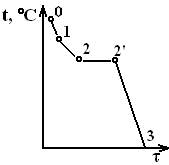
Sb>13%
Участок 01 – одна фаза (L)
1-2 – две фазы (L и тв. L)
2-2´ - три фазы (L, Pb, и Sb крист)
2´-3 – 2 фазы (тв. Pb + тв. Sb)
Изменяем температуру и концентрацию (или температуру и концентрацию)
01 С=2-1+1=2
1-2 С=2-2+1=1
2-2´ С=2-3+1-0
2´-3 С=2-2+1=1
Правило отрезков.
В процессе кристаллизации изменяется как концентрация фаз (например, из жидкостивыделяются кристаллы одного из компонентов, так и количество каждой фазы (количество твердой фазы увеличивается, а жидкой – умкеньшается). С помощью правила рычага или правила отрезков можно определить обе эти величины в любой точке диаграммы состояния.
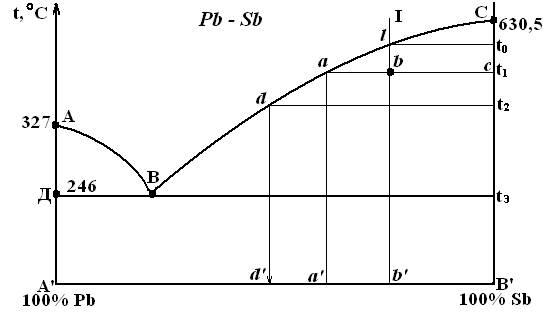
Для определения концентрации компонетов при заданной температуре, через т. t1 проводят горизонтальную линию до пересечения с кривыми, ограничивающими данную область. Проекции этих точек на ось концентраций позволяют определить состав фаз (концентрацию компонентов). В т. в (малая), показывающей состояние сплава Ι при температуре t1 сплав состоит из кисталлов Sb и жидкости. Выше т.l сплав находится в жидком состоянии и концентрация компонентов в этой фазе определяется проекцией т. l. При охлаждении из сплава выделятся кристаллы Sb и состав жидкости изменится в сторону увеличения в ней концентрации Рв. При t1 состав жидкости определяется проекцией т. а. По достижении эвтектической температуры (tэ) жидкость принимает эвтектическую концентрацию.
2-е положение правила отрезков: для того, чтобы определить количественное соотношение фаз, через заданную точку проводят горизонтальную линию. Отрезки этой линии между заданной точкой и точками, определяющими состав фаз, обратно пропорциональны количествам этих фаз.
Если масса сплава равна 1 и изображается отрезком ас, то масса кристаллов в точке «b» у сплава Ι равна Qтв= ab/ac
При количестве кристаллов х [Q ж ] количество жидкости 1-х= 1 – ab/ac= (ac – ab)/ac=bc/ac
Отношение Qтв/Qж = x /(1 – x) = ab/ac*ac/bc = ab/bc
Дата добавления: 2019-05-21; просмотров: 1104;











