ПРЕВРАЩЕНИЯ МЕТАЛЛОВ В ТВЕРДОМ СОСТОЯНИИ. МЕТАЛЛИЧЕСКИЕ СПЛАВЫ.
Атомы данного элемента могут образовать, если исходить только из геометрических соображений, любую кристаллическую решетку. Однако, реально существующим типом решетки, наиболее устойчивым, является решетка с низким запасом свободной энергии.
В ряде случаев при изменении температуры и давления для одного и того же металла становится устойчивой другая решетка.
Существование металла (вещества) в нескольких кристаллических формах носит название полиморфизма, или аллотропии.
Различные кристаллические формы одного вещества называются полиморфными или аллотропическими модификациями.
Аллотропические изменения характерны для таких металлов, как Co, Al, Sn, Mn, Ti, Zn, U, Fe. Это металлы, имеющие большое практическое значение.
Аллотропические формы обозначаются греческими буквами α, β, γ, δ и т.д. по мере повышения температуры. Т.е. при самой низкой температуре аллотропическая форма обозначается α. Эти индексы добавляются к соответствующим химическим символам.
Полиморфизм основан на законе устойчивости состояния с наименьшим запасом энергии, а запас свободной энергии зависит от температуры. Поэтому в одном интервале температур устойчива α-форма, а в другом – β и т.д.
Температура, при которой осуществляется переход из одной модификации в другую, называется температурой аллотропического превращения.
Полиморфные превращения происходят путем зарождения центров и роста кристаллов и имеют свои особенности для различных металлов. Рассмотрим аллотропические превращения на примере Fe.
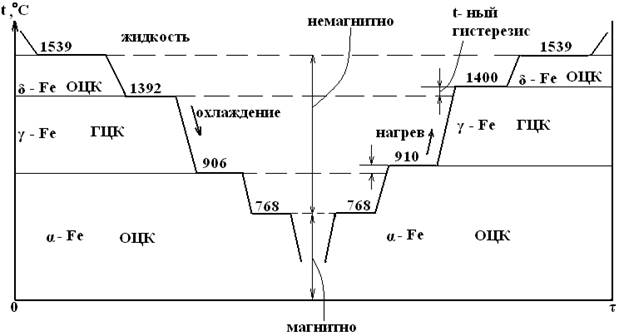
При температуре до 910 °С железо существует в форме α. При 9100С ОЦК Feα переходит в ГЦК Feγ, которая при 14000С вновь превращается в ОЦК Feα. Высокотемпературная α-решетка обозначается также δ (дельта). Таким образом, у железа одна и та же решетка устойчива в 2-х интервалах температур.
При температуре 7680С получается горизонтальный участок на кривой охлаждения, связанный не с перестройкой решетки, а с изменением магнитных свойств. Выше 7680С Fe магнитно и называют его иногда β (бэта) – Fe. Оно более пластично, вызко, обладает большей растворимостью углерода. При температуре 15390С – ОЦК трансформируется в жидкость.
Превращение одной аллотропической формы в другую при нагреве чистого металла сопровождается поглощением тепла и происходит при постоянной температуре. На термической кривой в координатах температура-время превращение отмечается горизонтальным участком. При охлаждении происходит выделение тепла (скрытой теплоты превращения), что приводит также к постоянству температуры. Вследствие переохлаждения эта температура более низка, чем при нагреве (возникает температурный гистерезис) – разница между реальными температурами плавления и кристаллизации.
Таким образом, суть аллотропических превращений заключается в переходе кристаллических решеток из одной в другую. Явление полиморфизма имеет большое практическое значение. На существовании аллотропических превращений основана термическая обработка стали.
2. Магнитные превращения.
Другим видом превращений в твердом состоянии являются магнитные превращения. И магнитные и полиморфные превращения называют вторичными, т.к. они происходят после кристаллизации.
Некоторые металлы, например, Fe, Co, Ni обладают способностью хорошо намагничиваться, т.е. эти металлы ферромагнитны. Но при нагреве ферромагнитные свойства металла постепенно теряются. Полная потеря ферромагнитных свойств происходит при определенной температуре, названной точкой Кюри, поскольку открыл это явление П. Кюри. Магнитные свойства Fe, Co, Ni в зависимости от температуры изменяются следующим образом:
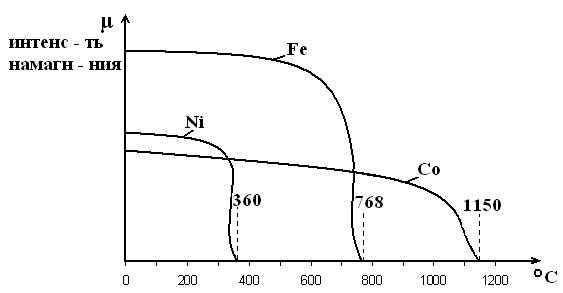
Сказанное не противоречит графическим данным: интенсивность намагничивания с повышением температуры постепенно снижается. Т.Кюри соответствует окончательной потере ферромагнетизма.
Магнитные превращения, в отличие от аллотропических, не сопровождаются изменением кристаллической решетки, перекристаллизацией (образованием новых зерен) и тепловым гистерезисом. Т.Кюри не означает скачкообразное изменение свойств. Механические и некоторые физические свойства не изменяются, изменяются электромагнитные и тепловые свойства.
Согласно современным представлениям, при магнитных превращениях происходят изменения во взаимодействии внешних электронных оболочек атомов.
3. Основные понятия о сплавах.
Чистые металлы не всегда отвечают требованиям, предъявляемым в современном машиностроении и других отраслях народного хозяйства, поэтому чаще в технике применяются сплавы.
Под сплавом понимают вещество, полученное сплавлением 2-х или более элементов. Они могут содержать и неметаллические элементы, сохраняя при этом свойства металла. В каждом сплаве различают компоненты (элементы) сплава и фазы [однородные части сплава с подобным кристаллическим строением и одинаковыми свойствами]. В зависимости от количества фаз сплавы могут быть однофазными, 2-х фазными и т.д.
Сплавы обладают большим диапазоном свойств по сравнению с чистыми металлами; легче поддаются термической и термомеханической обработке. В ряде случаев являются дешевле чистых металлов. В металлических сплавах основу составляют металлы:
Сталь - Fe (до 2,14%С)
Латунь - Cu (более 50% Cu; Zn)
Дуралюмин - Al (Al более 90%, Cu 4, Mg 0,5, Mn 0,5)
Строение сплава сложнее строения чистого металла и зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав.
Различают 3 типа взаимодействия:
1. Компоненты сплава могут химически взаимодействовать между собой, образуя химические соединения (AlSb, GaAs, InSb и др.).
2. Взаимно растворяться друг в друге, образуя твердые растворы, например, Ag - Au – неограниченный, Ni - Cu – неограниченный, Cu-Al – ограниченный (с эвтектикой).
3. Строение сплава может быть механической смесью отдельных частиц или зерен компонентов.
4. Механические смеси.
Примером механической смеси в сплавах является система Pb-Sb. Механические смеси образуются тогда, когда компоненты сплава не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соответствующего соединения. Основные признаки:
1. На микроструктуре такого сплава можно четко выделить кристаллы отдельных компонентов.
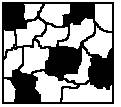
2. При рентгеноструктурном анализе твердого сплава можно наблюдать наличие 2-х типов кристаллических решеток.
3. Механические и другие свойства сплавов изменяются пропорционально изменению концентрации компонентов.
Если исследовать отдельно в сплавах механической смеси (как и в других сплавах) свойства кристаллов Рв и кристаллов Sb, то они тождественны со свойствами чистых компонентов.
5. Химические соединения в сплавах.
Они характеризуются определенным соотношением количества атомов элементов в соответствии со стехиометрической пропорцией (согласно формуле). При этом образуется более сложная кристаллическая решетка с упорядоченным расположением атомов, отличающаяся от решеток составляющих компонентов.
Химические соединения характеризуются также определенной температурой плавления (Тпл), скачкообразным изменением свойств при изменении состава (сингулярность свойств). Образование химических соединений сопровождается тепловым эффектом.
Если химическое соединение образуется только металлами, то в узлах решеток располагаются положительно заряженные ионы, удерживаемые электронным газом, т.е. имеет место металлическая связь.
Могут образовываться 2 вида химических соединений:
1. Химические соединения, подчиняющиеся правилу валентности, т.е. характеризующиеся наличием свободных (валентных) электронов и достроенностью электронных орбит у вступающих в соединение компонентов, например, Mg2Sn, MgS и др. Связь в этом случае жесткая и химический состав постоянный, т.е. не может быть избытка или недостатка в атомах какого-либо элемента.
2. Химические соединения, не подчиняющиеся правилу валентности. Образующаяся связь не является жесткой и поэтому количество какого-либо элемента может быть больше или меньше, чем это соответствует данной формуле химического соединения.
Таким образом, характерные признаки химических соединений таковы:
1. Определенное соотношение компонентов.
2. Сложность кристаллической решетки, отличающаяся от решеток составляющих компонентов.
3.Свойства сплава – химического соединения резко отличаются от свойств отдельных компонентов. Например, НВ Fe=50-150 кг/мм2; НВ графита=0; а НВ Fe3C>850 кг/мм2
Твердость по Бринеллю (НВ, Нв) устанавливается вдавливанием в образец испытываемого материала закаленного стального шарика определенного диаметра под действием заданной нагрузки в течение определенного времени с последующим измерением глубины и диаметра отпечатка. Число твердости:
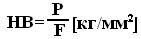
2. Твердые растворы.
В жидком состоянии большинство металлических сплавов представляет собой растворы. При переходе в твердое состояние во многих сплавах однородность строения сохраняется, следовательно, сохраняется и растворимость. Твердая фаза, образующаяся при кристаллизации такого сплава, называется твердым раствором. При этомы одного компонента (растворимого) определенным образом размещаются в кристаллической решетке другого компонента (растворителя). Растворителем может быть чистый металл или химическое соединение.
Характерные признаки твердого раствора:
1. При микроструктурном анализе невозможно выделить зерна отдельных компонентов.
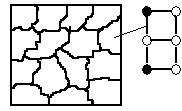
Схема микроструктуры твердого раствора.
● - атом компонента А
○ - атом компонента В
2. При рентгеноструктурном анализе выявляется только один тип кристаллической решетки, а именно кристаллическая решетка растворителя.
3. Механические и другие свойства сплава не изменяются пропорционально количеству компонентов.
Следовательно, в отличие от механической смеси, твердый раствор однофазен (имеет одну кристаллическую решетку), а в отличие от химического соединения твердый раствор существует не при строго определенном соотношении компонентов, а в интервале концентраций.
Различают 2 основных типа твердых растворов:
1. Твердые растворы замещения.
2. Твердые растворы внедрения.
Твердые растворы замещения образуются в случае, когда часть атомов в кристаллической решетке компонента В замещается атомами компонента А.
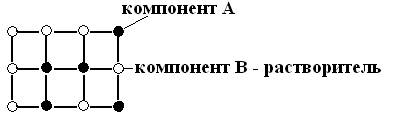
Замещение атомами А происходит незакономерно, беспорядочно.
Существуют:
а) твердые растворы замещения с неограниченной растворимостью компонентов. Например, система Cu-Ni (до 50% Ni - основа Cu, более 50% Ni - основа Ni).
Для образования таких растворов необходимы следующие условия:
1. Одинаковость типов кристаллических решеток компонентов.
2. Малая разница в размерах, диаметрах атомов компонентов, не более 10%.
3. Одинаковое строение электронных оболочек у взаимодействующих компонентов.
б) твердые растворы с ограниченной растворимостью.
1-е условие соблюдается, 2 и 3 могут не соблюдаться, например, Al-Cu сплав, при температруре 200С в Al – 0,5% Cu, при температуре 5470С в Al – 5,72% Cu.
Твердые растворы внедрения образуются путем внедрения атомов растворимого компонента в промежутке между атомами компонента – растворителя. Обычно растворы такого типа образуются между металлами и неметаллами, например, Fe-(C, N2, H2).
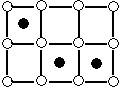
При известных условиях атомы растворенного элемента занимают определенные места в узлах решетки, т.е. от неупорядоченного расположения переходят в упорядоченное. Такие растворы называются упорядоченными твердыми растворами и являются промежуточными фазами между химическими соединениями и твердыми растворами.
Дата добавления: 2019-05-21; просмотров: 1444;











