Геометрическая оптика 5 глава
Проанализируем выражения (23.19) и (23.20). Прежде всего примечательно, что решение уравнения Шредингера для электрона в потенциальной яме без каких-либо дополнительных постулатов приводит к дискретным, квантованным значениям энергии:
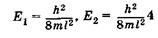 и т. д.
и т. д.
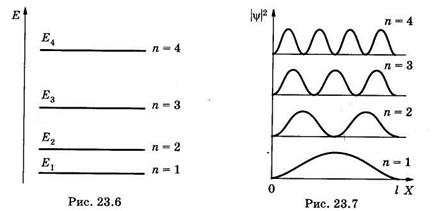
Энергетические уровни E1 E2, E3, E4, соответствующие разным Состояниям электрона, схематически показаны на рис. 23.6. Вычислим разность энергий соседних уровней га + 1и га:
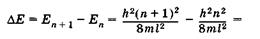
 (23.21)
(23.21)
Из (23.21) видно, что при некотором фиксированном значении га дискретность, т. е. различие энергий соседних уровней тем меньше, чем больше размеры потенциальной ямы. Так, например, рассмотри два случая при га = 1:
|
Возведя (23.20) в квадрат, получим плотность вероятности нахождения электрона в разных точках потенциальной ямы. 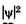 На рис. 23.7 показана графическая зависимость от х при разных дискретных состояниях, т. е. разных квантовых
На рис. 23.7 показана графическая зависимость от х при разных дискретных состояниях, т. е. разных квантовых 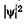 числах. Как видно из рисунка, электрон может с разной вероятностью находиться в разных местах потенциальной ямы. Есть такие точки, в кото-
числах. Как видно из рисунка, электрон может с разной вероятностью находиться в разных местах потенциальной ямы. Есть такие точки, в кото-

рых вероятность нахождения электрона вообще равна нулю. Это существенно отличается от представлений классической физики, согласно которым нахождение частицы в разных местах потенциальной ямы равновероятно (рис. 23.8), т. е. невозможно разделение ямы точками, в которых исключено нахождение частицы. Уравнение Шредингера можно применить и к более сложным силовым полям, например, к электрону в атоме. Это приведет к дополнительным математическим трудностям, но не изменит основных особенностей атомных систем: дискретности энергетических состояний, вероятностных суждений о нахождении электрона, своеобразной зависимости |\|/|2 от координат и т. д.
§ 23.6. Применение уравнения Шредингера к атому водорода. Квантовые числа
Описание состояний атомов и молекул с помощью уравнения Шредингера является достаточно сложной задачей. Наиболее просто она решается для одного электрона, находящегося в поле ядра. Такие системы соответствуют атому водорода и водородопо-добным ионам (однократно ионизированный атом гелия, двукратно ионизированный атом лития и т. п.). Однако и в этом случае решение задачи выходит за рамки нашего курса, поэтому ограничимся лишь качественным изложением вопроса.
Прежде всего в уравнение Шредингера (23.13) следует подставить потенциальную энергию, которая для двух взаимодействующих точечных зарядов -е (электрон) и Ze (ядро), находящихся на расстоянии г в вакууме, выражается следующим образом:
 (23.22)
(23.22)
При центральной симметрии поля, созданного ядром, удобнее решать задачу не в декартовых прямоугольных координатах, а в сферических 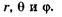
Решение уравнения Шредингера находят в виде произведения
функций:
 (23.23)
(23.23)
Аналогично тому, как для электрона в прямоугольной потенциальной яме с бесконечно высокими стенками граничные условия привели к конкретным возможным значениям функции у и энергии Еп, так и в потенциальной яме, соответствующей атому водорода, физические условия приводят к определенным типам функций fv f2, f3 и, следовательно, y-функции. Здесь также проявляется главная особенность квантово-механических систем — дискретность физических величин.
 Дискретность математически проявляется в том, что любой из функций, являющейся решением уравнения Шредингера с заданными граничными условиями и потенциальной энергии Еп, соответствует набор (спектр) целочисленных значений параметров, каждому из которых отвечает так называемое квантовое число. В отличие от прямоугольной потенциальной ямы с бесконечно высокими стенками состояние электрона в атоме водорода характеризуется не одним, а несколькими квантовыми числами. Решением уравнения Шредингера вводятся три квантовые числа: п, l, тl В общем случае квантовыми числами называют целые (0, ±1, ±2, ...) или полуцелые (+1/2, ±3/2, ±5/2…) числа, определяющие возможные дискретные значения физических величин, которые характеризуют квантовые системы.
Дискретность математически проявляется в том, что любой из функций, являющейся решением уравнения Шредингера с заданными граничными условиями и потенциальной энергии Еп, соответствует набор (спектр) целочисленных значений параметров, каждому из которых отвечает так называемое квантовое число. В отличие от прямоугольной потенциальной ямы с бесконечно высокими стенками состояние электрона в атоме водорода характеризуется не одним, а несколькими квантовыми числами. Решением уравнения Шредингера вводятся три квантовые числа: п, l, тl В общем случае квантовыми числами называют целые (0, ±1, ±2, ...) или полуцелые (+1/2, ±3/2, ±5/2…) числа, определяющие возможные дискретные значения физических величин, которые характеризуют квантовые системы.
Первое из них — главное квантовое число п = 1,2,3, ... . Оно определяет уровни энергии электрона в атоме водорода (z = 1) или водородоподобных ионах:
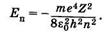
(23.24)
Это выражение вытекает из решения уравнения Шредингера и полностью совпадает с соответствующей формулой теории Бора (см. §23.7).
На рис. 23.9 штриховыми прямыми показаны уровни возможных значений полной энергии Е электронов в атоме водорода (E1 Е2, Е3 и т. д.) и график зависимоcти потенциальной энергии Еп от расстояния rмежду электроном и ядром [см. (23.22)]. С возрастанием главного квантового числа га увеличивается r [см., например, (23.33)],
а полная [см. (23.24)] и потенциальная энергии стремятся к нулю. Кинетическая энергия также стремится к нулю. Заштрихованная область (Е > 0) — непрерывный спектр значений энергии — соответствует состоянию свободного электрона.
Второе квантовое число — орбитальное квантовое число I, которое при данном п может принимать значения 0, 1, 2, ..., п — 1. Это число характеризует орбитальный момент импульса Ll электрона относительно ядра:
 (23.25)
(23.25)
Третье квантовое число — магнитное квантовое число тг, которое при данном l принимает значения 0, ±1, +2, ..., ±1, всего 21 + 1 значений. Это число определяет проекции орбитального момента импульса электрона на некоторое произвольно выбранное направление Z (или направление внешнего магнитного поля):
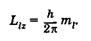 (23.26)
(23.26)
Четвертое квантовое число — спиновое {магнитное спиновое)1 квантовое число m8. Оно может принимать только два значения (±1/2) и характеризует возможные значения проекции на ось Z спина (собственного механического момента) электрона:
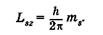 (23.27)
(23.27)
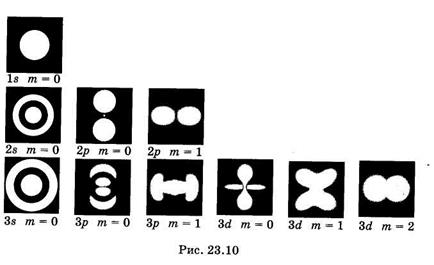
Состояния электрона в атоме с заданными п и I обозначают следующим образом: Is, 2s, 2p, 3s и т. д. Здесь цифра указывает значение главного квантового числа, а буква — орбитальное квантовое число: символам s, p, d, f, ... соответствуют значения I =0, 1, 2, 3 и т. д. (табл. 30).
Число состояний с заданными п и I равно 2(2l + 1). Чтобы найти общее число состояний, имеющих одинаковое главное квантовое число, просуммируем 2(2l + 1) по всем возможным значениям l от l = 0 до l = п - 1:
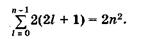 (23.28)
(23.28)
Таким образом, первому уровню энергии атома водорода соответствуют два состояния электрона, второму — 8, третьему — 18 и т. д. (см. табл. 30).
Наглядное представление о нахождении электрона в атоме дает фотомодель электронного облака (рис. 23.10). Снимки выполнены на модели со светящейся лампочкой. Рассчитав плотности вероятности  нахождения электрона в атоме в состояниях с разными значениями п, l и ml лампочку перемещали в соответствии с этим расчетом: больше времени она находилась в местах с большей плотностью вероятности, менее длительно — в местах с меньшей плотностью вероятности. В результате экспозиции на фотопленке получились места разной освещенности, которые иллюстрируют распределение вероятности нахождения электрона в атоме. Из рисунков видно, сколь условно и даже неверно понятие «орбита» применительно к движению электрона.
нахождения электрона в атоме в состояниях с разными значениями п, l и ml лампочку перемещали в соответствии с этим расчетом: больше времени она находилась в местах с большей плотностью вероятности, менее длительно — в местах с меньшей плотностью вероятности. В результате экспозиции на фотопленке получились места разной освещенности, которые иллюстрируют распределение вероятности нахождения электрона в атоме. Из рисунков видно, сколь условно и даже неверно понятие «орбита» применительно к движению электрона.
Спиновый и орбитальный магнитные моменты взаимодействуют между собой, это изменяет систему энергетических уровней атома по сравнению с той, которая была бы без такого взаимодействия. Спин-орбитальное взаимодействие приводит к расщеплению энергетических уровней и тонкой структуре спектральных линий излучения. Если это расщепление уровней существенно, то необходимо учитывать полный момент импульса электрона — орбитальный плюс спиновый. При этом вместо тп1 и ms используют другие квантовые числа: j и тj
Квантовое число j определяет дискретные значения полного момента импульса Lj. электрона:
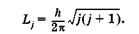 (23.29)
(23.29)
При заданном l квантовое число у принимает два значения: 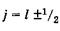
Таблица 30
i 
Магнитное квантовое число т, характеризует возможные проекции полного момента импульса электрона Lj. на некоторое произвольно выбранное направление Z, либо направление внешнего магнитного поля:
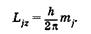 (23.30)
(23.30)
При заданном у квантовое число тj, принимает 2j + 1 значений: -j, -j + 1, ..., + j.
______________________
1 Наличие спина у частиц и спинового квантового числа не следует из уравнения Шредингера.
§ 23.7. Понятие о теории Бора
Еще до создания квантовой механики датский физик Н. Бор в 1913 г. предложил теорию атома водорода и водородоподобных ионов, которая основывалась на планетарной модели атома и двух постулатах. Постулаты Бора не укладывались в рамки классической физики.
Согласно первому постулату, атом и атомные системы могут длительно пребывать только в определенных стационарных состояниях. Находясь в таких состояниях, атом не излучает и не поглощает энергии. Стационарным состояниям соответствуют дискретные значения энергии: E1 Е2, …..•
Любое изменение энергии атома или атомной системы связано со скачкообразным переходом из одного стационарного состояния в другое.
По второму постулату, при переходе атома из одного состояния в другое атом испускает или поглощает фотон частоты v, энергия которого определяется разностью энергий Еj, Ek атомных состояний:
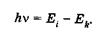 (23.31)
(23.31)
Переход из состояния с большей энергией в состояние с меньшей энергией сопровождается излучением фотона. Обратный процесс происходит при поглощении фотона.
Согласно теории Бора, электрон в атоме водорода вращается по круговой орбите вокруг ядра. Из всех возможных орбит стационарные состояния соответствуют только тем, для которых момент импульса (орбитальный механический момент) равен целому числу 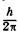 :
:
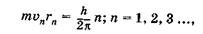 (23.32)
(23.32)
где т — масса электрона,  — его скорость на я-й орбите, rn— ее радиус.
— его скорость на я-й орбите, rn— ее радиус.
На электрон, вращающийся по круговой орбите в атоме (ионе), действует кулоновская сила притяжения со стороны положительно заряженного ядра, которая, по второму закону Ньютона, равна произведению массы электрона на центростремительное ускорение (запись дана для вакуума):
 (23.33)
(23.33)
где е — заряд электрона, Ze — заряд ядра. Для водорода Z = 1, для водородоподобных ионов Z > 1. Исключая v n из (23.32) и (23.33), получаем
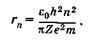 (23.34)
(23.34)
Используя (23.33), находим кинетическую энергию электрона:
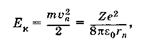 (23.35)
(23.35)
а сумма кинетической (23.35) и потенциальной (23.22) энергий дает полную энергию электрона:
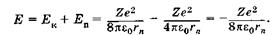 (23.36)
(23.36)
Подставляя выражение (23.34) в (23.36), получаем дискретные значения энергии 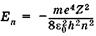 , как в квантово-механическом описании атомов (23.24).
, как в квантово-механическом описании атомов (23.24).
На основании второго постулата (23.31) и формулы (23.24) Бор получил формулу (24.14), объясняющую сериальные закономерности спектра атома водорода и водородоподобных ионов (см. § 24.3).
Теория Бора в свое время явилась триумфом развития атомной физики. Впервые, хотя и для простейшей атомной системы (один электрон вращается вокруг ядра), были раскрыты закономерности спектров.
Несмотря на большой успех теории Бора, скоро стали заметны и ее недостатки. Так, в рамках этой теории не удалось объяснить различия интенсивностей спектральных линий, т. е. ответить на вопрос, почему одни переходы между энергетическими уровнями более вероятны, чем другие. Теория Бора не раскрыла спектральных закономерностей более сложных атомных систем, в частности, атома гелия (с двумя электронами, вращающимися вокруг ядра).
Недостатком теории Бора была ее внутренняя противоречивость. Эта теория объединяла в себе положения принципиально отличных теорий: классической и квантовой физики. Так, например, в соответствии с теорией Бора считается, что электрон в атоме движется по определенным орбитам (классические представления), но при этом не излучает и не поглощает электромагнитной энергии (противоречит классической электродинамике).
В первой четверти двадцатого века стало ясно, что теория Бора должна быть заменена другой теорией атома, в связи с чем и появилась квантовая механика.
§ 23.8. Электронные оболочки сложных атомов
Квантовые числа, описывающие состояние электрона в атоме водорода, используют для приближенной характеристики состояния отдельных электронов сложных атомов. Однако при этом следует учитывать по крайней мере два существенных отличия сложных атомов от атома водорода: 1) в сложных атомах энергия электронов из-за их взаимодействия зависит не только от п, но и от /; 2) распределение электронов по энергетическим уровням обусловлено принципом Паули, согласно которому в атоме не может быть двух (и более) электронов с четырьмя одинаковыми квантовыми числами.
При образовании электронной конфигурации, соответствующей невозбужденному состоянию атома, каждый электрон стремится иметь наименьшую энергию. Если бы не принцип Паули, то все электроны расположились бы на самом нижнем энергетическом уровне. В действительности электроны последовательно заполняют состояния, которые указаны для атома водорода в табл. 30 (за некоторыми исключениями).
Электроны с одинаковым главным квантовым числом образуют слой. Слои обозначают буквами К, L, М, N и т. д. в соответствии с п = 1, 2, 3, 4, ... . Электроны, имеющие одинаковые пары значений n и l, входят в состав оболочки, которая кратко обозначается так же, как соответствующие состояния для электрона атома водорода: 1s, 2s, 2р и т. д. Так, например, называют 2в-оболочка, 2в-электроны и т. п.
Число электронов в оболочке обозначают справа вверху около символической записи оболочки, например 2p4.
Распределение электронов по оболочкам в атоме (электронные конфигурации) обычно указывают следующим образом: для азота (Z = 7) — Is2, 2s2, 2р3; для кальция (Z = 20) — Is2, 2s2, 2р6, 3s2, Зр6, 4s2 и т. д.
Так как энергия электронов сложных атомов зависит не только от n, но и от l, то построение таблицы Менделеева не всегда происходит постепенным заполнением слоев по мере усложнения атома. У калия (Z = 19), например, вместо заполнения слоя М (что соответствовало бы конфигурации Is2, 2s2, 2p6, 3s2, Зр6, 3d1) начинается заполнение слоя N и создается следующая электронная конфигурация: Is2, 2s2, 2р6, 3s2, Зр6, 4s1. Аналогичные отклонения от «регулярного» заполнения слоев имеются и у некоторых других элементов.
Всегда выполняется общее правило: электроны невозбужденного атома занимают состояние с наименьшей энергией и в соответствии с принципом Паули. На рис. 23.11 схематически без соблюдения масштаба показаны энергетические состояния и уровни сложного атома и соответствующее им число электронов.
 В заключение отметим, что состояние многоэлектронного атома в целом определяется следующими квантовыми числами: L — квантовым числом полного орбитального момента атома1, которое принимает значения 0, 1, 2, 3 и т. д.; J — квантовым числом полного момента атома, которое может принимать значения с интервалом в единицу от \L - S\ до L + S; S — квантовым числом результирующего спинового момента атома; магнитным квантовым числом то,, которое определяет дискретные значения проекции полного момента импульса атома LA на некоторую ось Z:
В заключение отметим, что состояние многоэлектронного атома в целом определяется следующими квантовыми числами: L — квантовым числом полного орбитального момента атома1, которое принимает значения 0, 1, 2, 3 и т. д.; J — квантовым числом полного момента атома, которое может принимать значения с интервалом в единицу от \L - S\ до L + S; S — квантовым числом результирующего спинового момента атома; магнитным квантовым числом то,, которое определяет дискретные значения проекции полного момента импульса атома LA на некоторую ось Z:
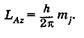 (23.37)
(23.37)
При заданном J квантовое число т.- принимает 2J+ 1 значений: -J, -J +1, ..., +J.
§ 23.9. Энергетические уровни молекул
Энергетические уровни молекул имеют более сложное строение, чем у атомов. Это вызвано тем, что в молекуле, кроме движения электронов относительно ядер, происходит колебательное движение атомов около их положения равновесия (колебание ядер вместе с окружающими их электронами) и вращательное движение молекулы как целого.
Электронному, колебательному и вращательному движениям молекулы соответствуют три типа уровней энергии: Еэл, Екол и Евр.
Согласно квантовой механике, энергия всех видов движения в молекуле принимает только дискретные значения (квантуется). Полная энергия Е молекулы может быть представлена суммой квантованных значений энергии разных видов:
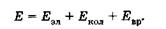 (23.38)
(23.38)
На рис. 23.12 схематически изображена система уровней молекулы! далеко отстоящие электронные уровни энергии а' и а", для которых Екол = Евр = 0; более близко расположенные колебательные уровни v' и v", для которых Евр = 0; наиболее тесно расположенные вращательные уровни J' и J" с различными значениями Е .
«Расстояние» между электронными уровнями энергии примерно 1—10 эВ, между соседними колебательными уровнями — 10 -2— 10 -1 эВ, между соседними вращательными уровнями — 10 -5—10 -3 эВ.
 Квантование колебательной энергии двухатомной молекулы можно объяснить, если рассматривать молекулу как гармонический осциллятор. Допустим, что атомы сопротивляются смещению из положения равновесия с силой
Квантование колебательной энергии двухатомной молекулы можно объяснить, если рассматривать молекулу как гармонический осциллятор. Допустим, что атомы сопротивляются смещению из положения равновесия с силой 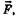 пропорциональной вели-
пропорциональной вели-
чине смещения х, тогда, следуя закону Гука (см. § 5.1), можно написать выражение для частоты колебаний двухатомного осциллятора (вибратора)
 (23.39)
(23.39)
где k — является мерой «упругости», или силы химической связи между атомами. Чем выше упругость или меньше масса атомов, тем выше частота колебаний.
На основании (5.25) можно написать выражение для потенциальной энергии осциллятора
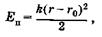 (23.40)
(23.40)
где (г - г0) — смещение относительно положения равновесия. Подставив (23.40) в уравнение Шредингера (23.14), получим
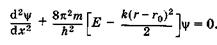 (23.41)
(23.41)
Решение уравнения (23.41) дает выражение для полной энергии колебаний Екол
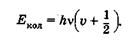 (23.42)
(23.42)
Величина v — колебательное квантовое число, которое может принимать значения 0, 1, 2, ...и т. д.
При аппроксимации двухатомной молекулы моделью гармонического осциллятора график зависимости потенциальной энергии (23.40) от межатомного расстояния (рис. 23.13) представляет собой параболу с равноотстоящими уровнями колебательной энергии. Горизонтальные кривые соответствуют Екол — полной энергии (кинетическая плюс потенциальная) вибратора на колебательных уровнях, характеризуемых значениями v = 0, 1, 2 и т. д.
Интересно, что даже на нижнем колебательном уровне (и = 0) в точке г = г0, соответствующей положению равновесия, молекула обладает половиной кванта колебательной энергии (см. рис. 23.14). Для молекулярного водорода это составляет 0,269 эВ. Молекула сохраняет такую колебательную энергию даже при абсолютном нуле.
Рассмотрим молекулу с колебательным уровнем v = 2 и первоначально находящуюся в состоянии сжатия (в точке С, межъядерное расстояние rc). Тогда вся энергия будет потенциальной, и кинетическая энергия осциллятора равна нулю. Такая молекула может колебаться между точками С и С. В точке r= г0 кинетическая энергия будет достигать максимума, а потенциальная будет равняться нулю.

Используя приближение классического осциллятора, можно предсказать, что максимальное смещение при колебательном движении соответствует двум точкам поворота С и С и что осциллятор должен находиться большую часть времени вблизи этих точек. Квантовая механика также предсказывает значения наибольшей плотности вероятности нахождения атомов в областях вблизи точек поворота, но значительно смещенных к центру (межъядерное расстояние г1). Это показано на рис. 23.13, где распределение плотности
вероятности 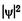 представлено для колебательных уровней двухатомной молекулы в зависимости от расстояния г между томами молекулярного гармонического осциллятора. Вместо простой классической картины с двумя максимумами вероятности (в точках А и А', В и В', С и С’) рис. 23.13 дает
представлено для колебательных уровней двухатомной молекулы в зависимости от расстояния г между томами молекулярного гармонического осциллятора. Вместо простой классической картины с двумя максимумами вероятности (в точках А и А', В и В', С и С’) рис. 23.13 дает  максимумов. При этом на нижнем колебательном уровне наиболее вероятно нахождение молекулы в положении r0, а на более высоких уровнях — ближе к областям точек поворота.
максимумов. При этом на нижнем колебательном уровне наиболее вероятно нахождение молекулы в положении r0, а на более высоких уровнях — ближе к областям точек поворота.
Модель гармонического осциллятора удовлетворительно описывает колебание двухатомной молекулы лишь при небольших смещениях r - r0, тогда как разрыв химических связей происходит при значительных смещениях ядер. Реальные кривые потенциальной энергии асимметричны, как это показано на рис. 23.14 на примере молекулы водорода. Гармонический осциллятор предсказывает серию равноотстоящих уровней колебательной энергии, однако в действительности (при асимметрии потенциальной кривой) уровни сгущаются с ростом и. В пределе, когда энергия колебаний становится равной энергии связи, дискретные уровни сливаются, и для энергий, превышающих энергию связи, получается сплошной спектр значений. Это означает, что при таких энергиях связь разрывается и атомы разлетаются с определенной относительной скоростью, соответствующей данному значению энергии в области сплошного спектра.
Существенный результат квантово-механических расчетов заключается в том, что в самом нижнем колебательном состоянии (v = 0) осциллятор обладает энергией так называемых нулевых
колебаний  . Классическое же решение задачи допускает решения, соответствующие покоящемуся осциллятору с энергией, равной нулю: такое состояние отвечало бы наличию определенной координаты г0 и определенной скорости, равной нулю, что противоречит соотношениям неопределенностей.
. Классическое же решение задачи допускает решения, соответствующие покоящемуся осциллятору с энергией, равной нулю: такое состояние отвечало бы наличию определенной координаты г0 и определенной скорости, равной нулю, что противоречит соотношениям неопределенностей.
В биологии и медицине особенно важны представления об энергетических состояниях сложных органических молекул, содержащих двойные ковалентные связи между атомами углерода.
Одинарную связь между атомами углерода образуют s-электроны (s-связь), в ее формировании участвуют два электрона с противоположными спинами (спаренные электроны). Они формируют единое вытянутое электронное облако, симметричное относительно прямой, соединяющей центры атомов. На рис. 23.15, а показаны s-связи между атомами углерода в n-гексане. Области перекрывания заштрихованы, они находятся в промежутках между атомами, s-орбитали соседних одинарных связей не перекрываются друг с другом.
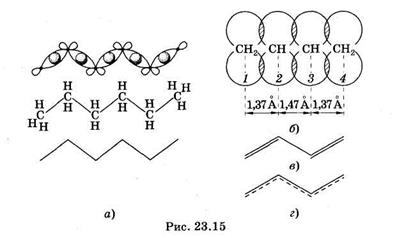
При возникновении между атомами углерода второй связи происходит перекрывание орбиталей еще двух электронов (р-орбиталей) соседних углеродных атомов. Их электронные облака имеют в сечении вид восьмерки, ось которой перпендикулярна направлению s-связи. Боковое перекрывание этих орбиталей в двух областях приводит к образованию молекулярной p-орбитали (рис. 23.15, б), соответственно электроны, формирующие p-орби-таль, называют p-электронами. Плотность образовавшегося облака л-электронов сосредоточена по обеим сторонам от линии s-связи. Она максимальна на расстоянии примерно 1 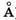 (10~10 м) от линии s-связи и обращается в нуль вблизи ядер атомов. Если двойные связи разделены одной одинарной (сопряжены), то происходит перекрывание p-орбиталей всех атомов углерода, участвующих в образовании цепочки сопряженных связей. На рис. 23.15, б показаны перекрывающиеся p-орбитали атомов углерода в молекуле бутадиена, одинарные s-связи условно изображены прямыми линиями, соединяющими атомы углерода. Данные о длине связей в молекуле бутадиена указывают на то, что при сопряжении двойных связей нет обычных двойных (длина связи
(10~10 м) от линии s-связи и обращается в нуль вблизи ядер атомов. Если двойные связи разделены одной одинарной (сопряжены), то происходит перекрывание p-орбиталей всех атомов углерода, участвующих в образовании цепочки сопряженных связей. На рис. 23.15, б показаны перекрывающиеся p-орбитали атомов углерода в молекуле бутадиена, одинарные s-связи условно изображены прямыми линиями, соединяющими атомы углерода. Данные о длине связей в молекуле бутадиена указывают на то, что при сопряжении двойных связей нет обычных двойных (длина связи
1,33 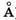 ) или одинарных (1,54
) или одинарных (1,54 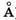 ) связей, связи являются примерно полуторными. Поэтому, хотя в органической химии и принято изображать систему сопряженных двойных связей, как показано на рис. 23.15, в, более точно ситуацию отображает рис. 23.15, г. Каждый электрон, участвующий в образовании двойной связи, оказывается принадлежащим не какой-то определенной паре атомов углерода, а сразу всей цепочке атомов, связанных сопряженными связями. Такие p-электроны делокализованы по всей цепочке и могут свободно по ней перемещаться подобно электронам проводимости в металле, но не могут ее покинуть. Другими словами электроны p-орбиталей находятся в потенциальной яме. Можно показать, что энергия этих электронов квантована, подобно энергии электронов в атоме.
) связей, связи являются примерно полуторными. Поэтому, хотя в органической химии и принято изображать систему сопряженных двойных связей, как показано на рис. 23.15, в, более точно ситуацию отображает рис. 23.15, г. Каждый электрон, участвующий в образовании двойной связи, оказывается принадлежащим не какой-то определенной паре атомов углерода, а сразу всей цепочке атомов, связанных сопряженными связями. Такие p-электроны делокализованы по всей цепочке и могут свободно по ней перемещаться подобно электронам проводимости в металле, но не могут ее покинуть. Другими словами электроны p-орбиталей находятся в потенциальной яме. Можно показать, что энергия этих электронов квантована, подобно энергии электронов в атоме.
Представим, что сопряженная цепь состоит из N звеньев, включающих по одной двойной и одной одинарной связи, тогда общая длина цепи равна
I = NL, (23.43)
где L — длина одного звена. Квантование энергий p-орбиталей является следствием волновых свойств электронов (23.2). Электрон (волна) перемещается по потенциальной яме длиной I со скоростью v, не выходя за ее пределы. Внутри ямы вся энергия электрона кинетическая, на краях ямы — потенциальная. Волна будет устойчива, если внутри ямы укладывается целое число п полуволн, т. е. если волна будет стоячей с узлами на стенках
Дата добавления: 2020-11-18; просмотров: 455;











