Геометрическая оптика 6 глава
 (23.44)
(23.44)
где л = 1, 2,3, ... ит. д. Подставив l, из формулы для длины волны де Бройля (23.2) в (23.44), находим возможные значения скорости электрона
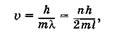
при этом его кинетическая энергия равна
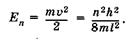 (23.45)
(23.45)
Видно, что формула (23.45) совпадает с (23.19), полученной при решении уравнения Шредингера для частицы в бесконечно глубокой потенциальной яме. Таким образом, энергия p-орбиталей квантована и может иметь только дискретные значения 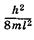 ,
,
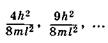 . Согласно принципу Паули на каждом уровне
. Согласно принципу Паули на каждом уровне
энергии могут находиться только два электрона с противоположными спинами. Следовательно, в основном (невозбужденном) состоянии 2N электронов p-орбиталей и p-членной цепи занимают N уровней с наименьшими значениями энергии от  до
до 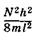
Молекулярные орбитали с энергиямии
и 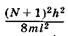 выше в основном состоянии молекулы будут оставаться свободными.
выше в основном состоянии молекулы будут оставаться свободными.
При поглощении квантов света может произойти переход какого-либо электрона с заполненного на свободный уровень. Молекула при этом оказывается в электронно-возбужденном состоянии. Кванты оптического (ультрафиолетового или видимого) излучения способны обычно вызывать электронные переходы только с верхнего заполненного (n = N) на нижний (n = N + 1) или следующий (n = N + 2) свободные уровни. Поэтому в оптической спектроскопии на схемах молекулярных энергетических уровней (рис. 23.16) изображают только верхний заполненный и нижние свободные уровни, тогда как нижние заполненные уровни не приводят совсем.
На рис. 23.16 представлена схема Яблонского энергетических уровней молекул с сопряженными связями, жирными горизонтальными линиями показаны электронные уровни, тонкими — колебательные, вращательные уровни не приведены. Рядом с уровнями в прямоугольных рамках схематически представлены основные и возбужденные состояния молекулы, стрелками показано направление спинов электронов. Состояния молекул, при которых спины имеют противоположное направление и сумма спиновых квантовых чисел равна нулю, называются синглетными и обозначаются буквами S с индексом внизу. Верхний заполненный уровень обозначают So, а свободные — S1 S2 и т. д. В электронно-возбужденных молекулах у электронов на уровнях S1 S2 и т. д. может произойти обращение спина, тогда молекула оказывается в триплетном возбужденном состоянии, обозначаемом T1 T2 и т. д. Сумма
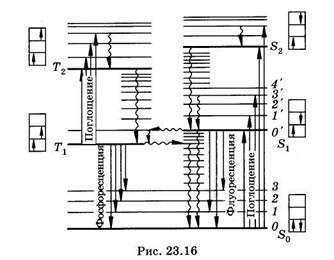
спиновых квантовых чисел молекул в триплетных состояниях равна единице1. Каждому возбужденному синглетному уровню соответствует один триплетный. По принципу Паули уровень То, соответствующий So, не существует, т. е. невозбужденная молекула не может быть в триплетном состоянии. Переходы между молекулярными энергетическими уровнями будут обсуждаться в главе 24.
______________________________
1 Не следует смешивать это обозначение с названием электронного слоя L и с символом полного момента импульса электрона.
ГЛАВА 24
Излучение и поглощение энергии атомами и молекулами
Огромное количество разных явлений происходит потому, что изменяется энергия атомов и молекул. Во многих случаях эффективное использование явления для практики оказывается возможным только с непременным учетом его молекулярной (атомной) природы.
В этой главе излагаются особенности излучения и поглощения энергии атомами и молекулами, а также некоторые практически важные явления, знание молекулярной природы которых существенно для их использования. Некоторые вопросы этой обширной темы рассматриваются в следующей главе.
§ 24.1. Поглощение света
Интенсивность света, распространяющегося в среде, может уменьшаться из-за поглощения и рассеяния его молекулами (атомами) вещества.
Поглощением света называют ослабление интенсивности света при прохождении через любое вещество вследствие превращения световой энергии в другие виды энергии.
 Поглощение кванта света происходит при его неупругом столкновении с молекулой (атомом), приводящем к передаче энергии фотона веществу, и является случайным событием. Вероятность поглощения кванта света образцом вещества толщиной l (рис. 24.1) оценивается величиной коэффициента поглощения 1-Т, равного отношению интенсивностей поглощенного света 1П = 10 - I к интенсивности падающего /0
Поглощение кванта света происходит при его неупругом столкновении с молекулой (атомом), приводящем к передаче энергии фотона веществу, и является случайным событием. Вероятность поглощения кванта света образцом вещества толщиной l (рис. 24.1) оценивается величиной коэффициента поглощения 1-Т, равного отношению интенсивностей поглощенного света 1П = 10 - I к интенсивности падающего /0
 (24.1)
(24.1)
где / — интенсивность прошедшего света, Т =I/I0 коэффициент пропускания.
Выведем закон поглощения света веществом. Выделим тонкий слой вещества dx, перпендикулярный пучку монохроматического света интенсивностью i (I0 > i > I), и будем исходить из предположения, что ослабление света (доля поглощенных квантов) -di/i таким слоем не зависит от интенсивности (если интенсивность не слишком велика), а определяется только толщиной слоя dx и коэффициентом пропорциональности  :
:
 (24.2)
(24.2)
Коэффициент  различен для разных длин волн и его величина зависит от природы вещества. Интегрируя (24.2) и подставив пределы интегрирования для х от 0 до I и для i от I0 до I, получаем
различен для разных длин волн и его величина зависит от природы вещества. Интегрируя (24.2) и подставив пределы интегрирования для х от 0 до I и для i от I0 до I, получаем

откуда, потенцируя, имеем
 (24.3)
(24.3)
Эта формула выражает закон поглощения света Бугера. Коэффициент 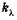 называют натуральным показателем поглощения, его величина обратна расстоянию, на котором интенсивность света ослабляется в результате поглощения в среде в е раз.
называют натуральным показателем поглощения, его величина обратна расстоянию, на котором интенсивность света ослабляется в результате поглощения в среде в е раз.
Так как поглощение света обусловлено взаимодействием с молекулами (атомами), то закон поглощения можно связать с некоторыми характеристиками молекул. Пусть п — концентрация молекул (число молекул в единице объема), поглощающих кванты света. Обозначим буквой s эффективное сечение поглощения молекулы — некоторую площадь, при попадании фотона в которую происходит его захват молекулой. Другими словами молекулу можно представить как мишень определенной площади.
Если считать, что площадь сечения прямоугольного параллелепипеда (рис. 24.1) равна S, то объем выделенного слоя Sdx, а количество молекул в нем nSdx; суммарное эффективное сечение всех молекул в этом слое будет snSdx. Доля площади поперечного сечения поглощения всех молекул в общей площади сечения
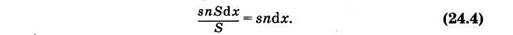
откуда после интегрирования и потенцирования имеем

Можно считать, что такая же, как и (24.4), часть попавших на слой квантов поглощается молекулами, ибо отношение площадей определяет вероятность взаимодействия одного кванта с молекулами выделенного слоя. Доля поглощенных слоем квантов равна относительному уменьшению интенсивности (di/i) света. На основании изложенного можно записать 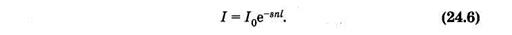
В это уравнение, аналогичное (24.3), входит параметр s, который отражает способность молекул поглощать монохроматический свет используемой длины волны.
Более приняты молярные концентрации С = n/NA, откуда п=CNA. Преобразуем произведение sn = sCNA = XlC, где Xl= sNA — натуральный молярный показатель поглощения. Его физический смысл — суммарное эффективное сечение поглощения всех молекул одного моля вещества. Если молекулы, поглощающие кванты, находятся в растворителе, который не поглощает свет, то можно (24.6) записать в виде

Эта формула выражает закон Бугера—Ламберта—Бера. Влабораторной практике этот закон обычно выражают через показательную функцию с основанием 10:


молярный показатель поглощения2.
 Закон Бугера—Ламберта—Бера используют для фотометрического определения концентрации окрашенных веществ. Для этого непосредственно измеряют потоки падающего и прошедшего через раствор монохроматического света (концентрационная колориметрия), однако определенный таким образом коэффициент пропускания Т (или поглощения 1 - Т, см. (24.1)) неудобен, так как он из-за вероятностного характера процесса3 связан с концентрацией нелинейно [см. (24.8) и рис. 24.2, а]. Поэтому в количественном анализе обычно определяют оптическую плотность (D) раствора3,
Закон Бугера—Ламберта—Бера используют для фотометрического определения концентрации окрашенных веществ. Для этого непосредственно измеряют потоки падающего и прошедшего через раствор монохроматического света (концентрационная колориметрия), однако определенный таким образом коэффициент пропускания Т (или поглощения 1 - Т, см. (24.1)) неудобен, так как он из-за вероятностного характера процесса3 связан с концентрацией нелинейно [см. (24.8) и рис. 24.2, а]. Поэтому в количественном анализе обычно определяют оптическую плотность (D) раствора3,

представляющую десятичный логарифм величины, обратной коэффициенту пропускания,
Оптическая плотность удобна тем, что она линейно связана с концентрацией определяемого вещества (рис. 24.2, б).
Закон Бугера—Ламберта—Бера выполняется не всегда. Он справедлив при следующих предположениях: 1) используется монохроматический свет; 2) молекулы растворенного вещества в растворе распределены равномерно; 3) при изменении концентрации характер
взаимодействия между растворенными молекулами не меняется (иначе фотофизические свойства вещества, в том числе и значения she, будут изменяться); 4) в процессе измерения не происходят химические превращения молекул под действием света; 5) интенсивность падающего света должна быть достаточно низка (чтобы концентрация невозбужденных молекул практически не уменьшалась в ходе измерения). Зависимости s, %, е или D от длины волны света называют спектрами поглощения вещества.
Спектры поглощения являются источниками информации о состоянии вещества и о структуре энергетических уровней атомов и молекул (см. § 24.3 и 24.4). Спектры поглощения используют для качественного анализа растворов окрашенных веществ.

1 Так как результирующий спиновый момент равен единице, то в магнитном поле происходит расщепление энергетического уровня на три (см. § 25.1), отсюда и термин «триплетный» уровень. Триплетные состояния молекул были открыты А. Н. Терениным в 1943 г.
2 В спектроскопии e принято называть молярным коэффициентом поглощения.
3 Экспоненциальная зависимость интенсивности прошедшего светаот концентрации вещества (24.6—24.8) определяется вероятностным характером поглощения квантов света. Доля поглощенных квантов di/I (24.5) может рассматриваться как вероятность поглощения, зависящая от суммарной площади поглощающих кванты мишеней в тонком слое образца sndx (24.5). Попадание или непопадание кванта в мишень — случайный, вероятностный процесс. Аналогичные экспоненциальные зави-
симости, отражающие вероятностный характер процессов, получаются при выводе уравнений, описывающих распределение Больцмана (§ 2.4), ослабление рентгеновского излучения веществом (§ 26.3) или радиоактивный распад (§ 27.2).
4 В англоязычной литературе сейчас вместо оптической плотности используется другое обозначение и термин: поглощательная способность
(A) (absorbance).
§ 24.2. Рассеяние света
Рассеянием света называют явление, при котором распространяющийся в среде световой пучок отклоняется по всевозможным направлениям.
Необходимое условие для возникновения рассеяния света — наличие оптических неоднородностей, т. е., в частности, областей с иным, чем основная среда, показателем преломления.
Рассеяние света возникает на оптических неоднородностях среды. Различают два основных вида таких неоднородностей:
1) 1) мелкие инородные частицы в однородном прозрачном веществе. Такие среды являются мутными: дым (твердые частицы в газе), туман (капельки жидкости в газе), взвеси, эмульсии и т. п. Рассеяние в мутных средах называют явлением Тиндаля;
2) 2) оптические неоднородности, возникающие в чистом веществе из-за статистического отклонения молекул от равномерного распределения (флуктуации плотности). Рассеяние света на неоднородностях этого типа называют молекулярным, например рассеяние света в атмосфере.
Уменьшение интенсивности света вследствие рассеяния, как и при поглощении, описывают показательной функцией
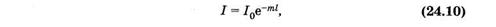
где m — показатель рассеяния (натуральный).
При совместном действии поглощения и рассеяния света ослабление интенсивности также является показательной функцией
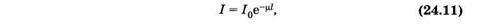
где m — показатель ослабления (натуральный). Как нетрудно видеть, m = m + kl.

Рэлей установил, что при рассеянии в мутной среде на неоднородностях, приблизительно меньших 0,2l (l — длина волны света), а также при молекулярном рассеянии интенсивность рассеянного света обратно пропорциональна четвертой степени длины волны (закон Рэлея):

Это означает, что из белого света веществом, например в точке Д (рис. 24.3), будут преимущественно рассеиваться голубые и фиолетовые лучи (направление А), а красные — проходить в направлении Б падающего света. Аналогичное явление наблюдается и в природе: голубой цвет неба — рассеянный свет, красный цвет заходящего Солнца — изменение спектра белого света из-за значительного рассеяния голубых и фиолетовых лучей в толще атмосферы при наклонном падении (см. пояснение к рис. 22.3).
Меньшее рассеяние красных лучей используют в сигнализации: опознавательные огни на аэродромах, наиболее ответственный свет светофора — красный, и т. п. Инфракрасные лучи рассеиваются еще меньше. На рис. 24.4 изображены две фотографии пейзажа: на левой, снятой обычным методом, туман сильно ограничил видимость; на правой, снятой в инфракрасном излучении на специальной пластинке, туман не мешает, он оказался прозрачным для более длинных волн.
Если взвешенные частицы велики по сравнению с длиной волны, то рассеяние не соответствует закону Рэлея (24.12) — в знаменателе дроби будет стоять X2. Рассеянный свет теряет свою голубизну и становится белее. Так, пыльное небо городов кажется нам белесым в противоположность темно-синему небу чистых морских просторов. 
Направление рассеянного света, степень его поляризации, спектральный состав и т. д. приносят информацию о параметрах, характеризующих межмолекулярное взаимодействие, размерах макромолекул в растворах, частиц в коллоидных растворах, эмульсиях, аэрозолях и т. д. Методы измерения рассеянного света с целью получения такого рода сведений называют нефелометрией, а соответствующие приборы — нефелометрами.
Еще один тип рассеяния света, названный комбинационным рассеянием, был открыт в 1928 г. Г. С. Ландсбергом и Л. И. Мандельштамом в Москве и одновременно Ч. В. Раманом в Индии. Это явление заключается в том, что в спектре рассеяния помимо несмещенной линии, соответствующей частоте падающего света, появляются новые линии, частоты которых n' представляют собой комбинацию частоты падающего света n0 и частот vi(i = 1, 2, ...) колебательных или вращательных переходов рассеивающих молекул:
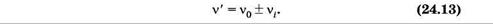
Комбинационное рассеяние можно рассматривать как неупругое соударение квантов с молекулами. При соударении квант может отдать молекуле или получить от нее только такие количества энергии, которые равны разностям двух ее энергетических уровней. Если при столкновении с квантом молекула переходит из состояния с энергией Е' в состояние с энергией Е" (Е" > Е'), то энергия фотона после рассеяния станет равной hv0 - DЕ, где DЕ = Е" - Е'. Соответственно частота кванта уменьшится на n1 = DE/h — возникает спутник с большей длиной волны, который условно называют «красным». Если первоначально молекула находилась в состоянии с энергией Е", она может перейти в результате соударения с фотоном в состояние с энергией Е', отдав избыток энергии DЕ = Е" - Е' кванту. В результате энергия кванта станет равной hvQ + DЕ и частота увеличится на n1 — возникает спутник с меньшей длиной волны, называемый «синим». Рассеяние кванта hv0 может сопровождаться переходами молекулы между различными вращательными или колебательными уровнями Е', Е", Е'" и т. д. В результате возникает ряд симметрично расположенных спутников.
С помощью метода комбинационного рассеяния определяются собственные частоты колебаний молекулы; он позволяет также судить о характере симметрии молекулы. Спектры комбинационного рассеяния настолько характерны для молекул, что с их помощью осуществляется анализ сложных молекулярных смесей. Спектроскопия комбинационного рассеяния дает информацию, аналогичную получаемой инфракрасной спектроскопией, но имеет то преимущество, что позволяет работать с водными растворами молекул, используя видимый свет, для которого растворитель прозрачен.
§ 24.3. Оптические атомные спектры
Атомными спектрами1 называют как спектры испускания, так и спектры поглощения, которые возникают при квантовых переходах между энергетическими уровнями свободных или слабовзаимодействующих атомов.
Электроны в атомах могут находиться в стационарных энергетических состояниях. В этих состояниях атомы не излучают и не поглощают энергии. Энергетические состояния схематически изображают в виде уровней (см., например, рис. 23.11). Число электронов в атоме ограничено, при отсутствии внешних воздействий они заполняют только часть возможных электронных энергетических уровней с наименьшей энергией. Таким образом, оказываются заполненными нижние электронные уровни, тогда как верхние остаются свободными. Состояние атома с возможной минимальной энергией называют основным. Если атом получает энергию (например, при соударении с другими атомами или при поглощении кванта света), то может произойти переход какого-либо электрона с заполненного на более высокий свободный уровень. При этом атом оказывается в электронно-возбужденном состоянии с избыточной энергией.
Поглощение кванта возможно при условии, если его энергия равна разности энергий какого-либо свободного электронного уровня (_Еi) и заполненного (Ek): hv = Ei - Ek, i > k (23.31). Эта формула выражает закон сохранения энергии.
Возбужденные атомы стремятся перейти в состояние с наименьшей энергией. Поэтому происходят спонтанные квантовые переходы Ei -> Ek. Такие переходы могут быть безызлучательными (энергия передается окружающим атомам при столкновениях, вызывая нагрев тела) или излучательными с испусканием квантов света, энергия которых выражается формулой (23.31). Спонтанное излучение определяется в основном внутренними причинами, является случайным событием и имеет вероятностный характер. Обычные источники света испускают в основном спонтанное излучение.
Особо выделяется другой вид излучения, который называется вынужденным, или индуцированным. Оно возникает при взаимодействии кванта с возбужденным атомом и будет рассмотрено в § 24.8.
Наибольший интерес представляют оптические атомные спектры испускания, которые получают от возбужденных атомов. Их возбуждение обычно достигается при электрическом разряде в газе или нагревании вещества пламенем газовых горелок, электрической дугой или искрой.
Атомные спектры в результате квантования энергии электронов и в соответствии с формулой (23.31) состоят из отдельных линий поглощения или испускания. Подробные сведения о спектрах конкретных атомов можно найти в специальных справочниках по спектроскопии. В качестве простого примера рассмотрим спектр атома водорода и водородоподобных ионов.
Из формул (23.24) и (23.31) можно получить формулу для частоты света, излучаемого (поглощаемого) атомом водорода (Z = 1):

где i и k — порядковые номера уровней, между которыми происходит переход. Эта формула была получена на основании эксперимента И. Я. Бальмером еще задолго до создания квантовой механики и теоретически обоснована Бором (см. § 23.7).
В спектре можно выделить группы линий, называемые спектральными сериями. Каждая серия применительно к спектрам испускания соответствует переходам с различных уровней на один и тот же конечный (рис. 24.5).
В ультрафиолетовой области находятся линии серии Лаймана, которая образуется при переходе с верхних энергетических уровней на самый нижний, основной (nk = 1).
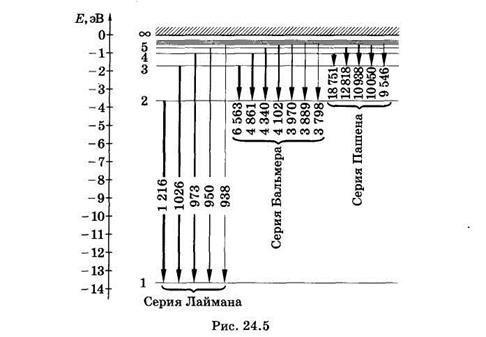
Из формулы (24.14) для серии Лаймана получаем

т. е. находим частоты всех линий этой серии. Самая длинноволновая линия имеет наибольшую интенсивность. Интенсивности спектральных линий на рис. 24.5 условно показаны толщиной линий, отображающих соответствующие переходы.
В видимой и близкой ультрафиолетовой областях спектра расположена серия Баль- мера, которая возникает вследствие переходов с верхних энергетических уровней на второй (nk = 2). Из формулы (24.14) для серии Бальмера получаем
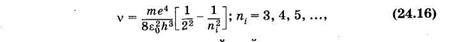
т. е. находим частоты всех линии этой серии.
К инфракрасной области относится серия Пашена, которая возникает при переходах с верхних энергетических уровней на третий (пк = 3). Из формулы (24.14) для серии Пашена следует

Существуют и другие серии в инфракрасной области. Может показаться, что спектр атомарного водорода не ограничен со стороны малых частот, так как энергетические уровни по мере увеличения га становятся сколь угодно близкими. Однако на самом деле вероятность перехода между такими уровнями столь мала, что практически эти переходы не наблюдаются.
Выражение для работы ионизации атома водорода Аи = hv и потенциала ионизации (12.60) можно получить из (24.14), считая

Для атомного спектрального анализа используют как спектры испускания (эмиссионный спектральный анализ), так и спектры поглощения (абсорбционный атомный спектральный анализ). Эмиссионный анализ часто служит для количественного определения микроэлементов в различных образцах, небольшого количества атомов металлов в консервированных продуктах и т. п.
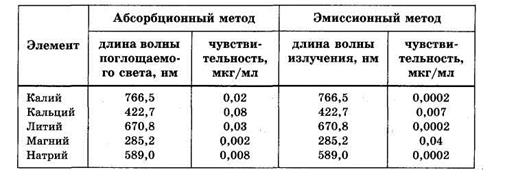
Высокочувствительным и простым методом обнаружения микроколичеств щелочных и щелочноземельных металлов является пламенная фотометрия. Всего этим методом определяют около 50 элементов. Раствор анализируемых веществ распыляют в пламя газовой горелки, где вследствие высокой температуры вещества переходят в парообразное состояние. При этом проводят регистрацию спектров и интенсивности полос поглощения или испускания атомов. Эмиссионный метод обычно обладает большей чувствительностью, чем абсорбционный (см. таблицу 31, где указаны длины волн наиболее интенсивных линий). Так как электронные переходы различных атомов отличаются по длине волны, возможно качественное и количественное определение сразу нескольких элементов в сложных смесях, какими являются многие биологические жидкости.
Таблица 31

1 Атомные спектры называют оптическими, если они лежат в ультрафиолетовом (100—400 нм), видимом (400—760 нм) или инфракрасном (X >760 нм) диапазоне длин волн.
§ 24.4. Молекулярные спектры
Молекулярные спектры (испускания и поглощения) возникают при квантовых переходах молекул с одного энергетического уровня на другой (см. § 23.9) и состоят из совокупности более или менее широких полос, которые представляют собой тесно расположенные линии. Сложность молекулярных спектров по сравнению с атомными обусловлена большим разнообразием движений и, следовательно, энергетических переходов в молекуле.
Учитывая (23.31) и (23.38), находим частоту, излучаемую или поглощаемую молекулой:
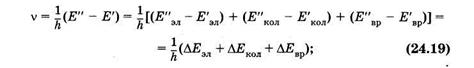
здесь один или два штриха относятся к нижнему и верхнему уровням соответственно. Следует иметь в виду, что DЕэл >> DЕК0Л >> DEвр . Если DЕЭЛ = 0 и DЕкол = 0, а DЕвр ¹ 0, то получают состоящие из отдельных линий чисто вращательные молекулярные спектры, которым отвечают [см. (24.18)] невысокие частоты. Такие спектры наблюдаются в далекой инфракрасной и микроволновой (СВЧ) областях.
 Если DЕэл = 0, а DЕКОЛ ¹0, то обычно одновременно и DЕвр¹0, при этом возникает колебательно-вращательный спектр. Он состоит из колебательных полос, распадающихся при достаточном разрешении спектрального прибора на отдельные вращательные линии. На рис. 24.6 графически изображен колебательно-вращательный спектр метана. Колебательно-вращательные спектры наблюдают в близкой инфракрасной области. (Колебательно-вращательные спектры можно также регистрировать методом комбинационного рассеяния, см. § 24.2.)
Если DЕэл = 0, а DЕКОЛ ¹0, то обычно одновременно и DЕвр¹0, при этом возникает колебательно-вращательный спектр. Он состоит из колебательных полос, распадающихся при достаточном разрешении спектрального прибора на отдельные вращательные линии. На рис. 24.6 графически изображен колебательно-вращательный спектр метана. Колебательно-вращательные спектры наблюдают в близкой инфракрасной области. (Колебательно-вращательные спектры можно также регистрировать методом комбинационного рассеяния, см. § 24.2.)
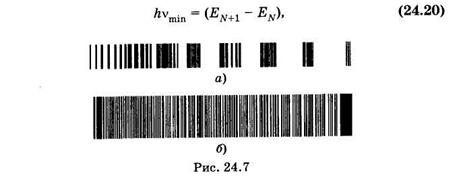
При DЕЭЛ¹0 обычно одновременно DЕкол¹0 и DЕвр¹0. Образуются электронно-колебательные, а точнее — электронно-колебательно-вращательные спектры, которые состоят из различных полос, а полосы — из тесно расположенных линий, соответствующихвращательным переходам. На рис. 24.7, а приведен электронно-колебательный спектр молекулы азота, а на рис. 24.7, б — вращательное расщепление одной из полос.
Электронно-колебательно-вращательные спектры испускания и поглощения наблюдают в видимой и ультрафиолетовой областях.
В сложных многоатомных молекулах с сопряженными двойными связями способность поглощать свет определяется главным образом молекулярными p-орбиталями. При взаимодействии молекулы с квантом света может произойти его поглощение при выполнении условия (23.31) равенства энергии кванта разности энергий какого-либо свободного и заполненного уровней.
Рассмотрим, как протяженность системы сопряженных связей влияет на положение максимума спектра поглощения вещества, т. е. на его окраску.
Вычислим частоту nmin, соответствующую минимальной энергии поглощаемых квантов для электронного перехода с верхнего заполненного на нижний свободный уровень (см. § 23.9)
откуда на основании (23.45) получим:
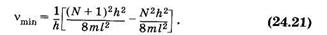
Дата добавления: 2020-11-18; просмотров: 418;











