Геометрическая оптика 8 глава
 Основным конструктивным элементом гелий-неонового лазера (рис. 24.18) является газоразрядная трубка диаметром около 7 мм. В трубку вмонтированы электроды для создания газового разряда и возбуждения гелия. На концах трубки под углом Брюстера (§ 20.2) расположены окна, благодаря которым излучение оказывается плоскополяризованным. Плоскопараллельные зеркала резонатора монтируются вне трубки, одно из них полупрозрачное (коэффициент отражения R < 100%). Таким образом, пучок вынужденного излучения выходит наружу через полупрозрачное зеркало. Это лазер непрерывного действия. Так как уровни 2 и 3 неона обладают сложной структурой (на рис. 24.17, в не показано), то гелий-неоновый лазер может работать на 30 длинах волн в области видимого и инфракрасного диапазонов.
Основным конструктивным элементом гелий-неонового лазера (рис. 24.18) является газоразрядная трубка диаметром около 7 мм. В трубку вмонтированы электроды для создания газового разряда и возбуждения гелия. На концах трубки под углом Брюстера (§ 20.2) расположены окна, благодаря которым излучение оказывается плоскополяризованным. Плоскопараллельные зеркала резонатора монтируются вне трубки, одно из них полупрозрачное (коэффициент отражения R < 100%). Таким образом, пучок вынужденного излучения выходит наружу через полупрозрачное зеркало. Это лазер непрерывного действия. Так как уровни 2 и 3 неона обладают сложной структурой (на рис. 24.17, в не показано), то гелий-неоновый лазер может работать на 30 длинах волн в области видимого и инфракрасного диапазонов.
Зеркала резонатора делают с многослойными покрытиями, и вследствие интерференции создается необходимый коэффициент отражения для заданной длины волны. Чаще всего используются гелий-неоновые лазеры, излучающие красный свет с длиной волны 632,8 нм. Мощность таких лазеров небольшая, она не превышает 100 мВт.
Применение лазеров основано на свойствах их излучения: высокая монохроматичность (Dl»0,01 нм), достаточно большая мощность, узость пучка и когерентность.
Узость светового пучка и малая его расходимость позволили использовать лазеры для измерения расстояния между Землей и Луной (получаемая точность — около десятков сантиметров), скорости вращения Венеры и Меркурия и др.
На когерентности лазерного излучения основано их применение в голографии (см. § 19.8). На основе гелий-неонового лазера с использованием волоконной оптики разработаны гастроскопы, которые позволяют голографически формировать объемное изображение внутренней полости желудка.
Монохроматичность лазерного излучения очень удобна при возбуждении спектров комбинационного рассеяния света атомами и молекулами (см. § 24.3).
Широкое применение лазеры нашли в хирургии, стоматологии, офтальмологии, дерматологии, онкологии. Биологические эффекты лазерного излучения зависят как от свойств биологического материала, так и от свойств лазерного излучения.
Все лазеры, используемые в медицине, условно подразделяются на 2 вида: низкоинтенсивные (интенсивность не превышает 10 Вт/см2, чаще всего составляет около 0,1 Вт/см2) — терапевтические и высокоинтенсивные — хирургические. Интенсивность наиболее мощных лазеров может достигать 1014 Вт/см2, в медицине обычно используются лазеры с интенсивностью 102— 106 Вт/см2.
Низкоинтенсивные лазеры — это такие, которые не вызывают заметного деструктивного действия на ткани непосредственно во время облучения. В видимой и ультрафиолетовой областях спектра их эффекты обусловлены фотохимическими реакциями и не отличаются от эффектов, вызываемых монохроматическим светом, полученным от обычных, некогерентных источников (см. § 24.9). В этих случаях лазеры являются просто удобными монохроматическими источниками света, обеспечивающими точную локализацию и дозированность воздействия. Примерами может служить использование света гелий-неоновых лазеров для лечения трофических язв, ишемической болезни сердца и др., а также криптоновых и др. лазеров для фотохимического повреждения опухолей в фотодинамической терапии.
Качественно новые явления наблюдаются при использовании видимого или ультрафиолетового излучения высокоинтенсивных лазеров. В лабораторных фотохимических экспериментах с обычными источниками света, а также в природе при действии солнечного света обычно осуществляется однофотонное поглощение. Об этом говорится во втором законе фотохимии4,сформулированном Штарком и Эйнштейном: каждая молекула, участвующая в химической реакции, идущей под действием света, поглощает один квант излучения, который вызывает реакцию.Однофотонность поглощения, описываемая вторым законом, выполняется потому, что при обычных интенсивностях света практически невозможно одновременное попадание в молекулу, находящуюся в основном состоянии, двух фотонов. Если бы такое событие осуществилось, то выражение (23.31) приобрело бы вид:
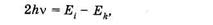
что означало бы суммирование энергии двух фотонов для перехода молекулы из энергетического состояния Ек в состояние с энергией Et. He происходит также поглощения фотонов электронно-возбужденными молекулами, так как их время жизни мало, а обычно используемые интенсивности облучения невелики.
Поэтому концентрация электронно-возбужденных молекул низка, и поглощение ими еще одного фотона чрезвычайно маловероятно.
Однако если увеличить интенсивность света, то становится возможным двухфотонное поглощение. Например, облучение растворов ДНК высокоинтенсивным импульсным лазерным излучением с длиной волны около 266 нм приводило к ионизации молекул ДНК, подобной вызываемой у-излучением. Воздействие ультрафиолета с низкой интенсивностью ионизации не вызывало. Установлено, что при облучении водных растворов нуклеиновых кислот или их оснований пикосекундными (длительность импульса 30 пс) или наносекундными (10 нс) импульсами с интенсивностями выше 106 Вт/см2 приводило к электронным переходам, показанным на рис. 24.19, завершавшимся ионизацией молекул.
 При пикосекундных импульсах (рис. 24.19, а) заселение высоких электронных уровней происходило по схеме
При пикосекундных импульсах (рис. 24.19, а) заселение высоких электронных уровней происходило по схеме
а при наносекундных (рис. 24.19, б) — по схеме

В обоих случаях молекулы получали энергию, превышающую энергию ионизации.
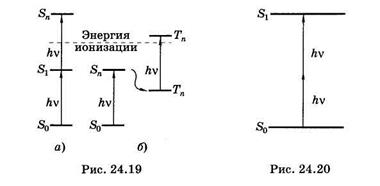
Полоса поглощения ДНК располагается в ультрафиолетовой области спектра при l < 315 нм, видимый свет нуклеиновые кислоты совсем не поглощают. Однако воздействие высокоинтенсивным лазерным излучением около 532 нм переводит ДНК в электронно-возбужденное состояние за счет суммирования энергии двух фотонов (рис. 24.20).
Поглощение любого излучения приводит к выделению некоторого количества энергии в виде тепла, которое рассеивается от возбужденных молекул в окружающее пространство. Инфракрасное излучение поглощается главным образом водой и вызывает в основном тепловые эффекты. Поэтому излучение высокоинтенсивных инфракрасных лазеров вызывает заметное немедленное тепловое действие на ткани. Под тепловым воздействием лазерного излучения в медицине понимают в основном испарение (резание) и коагуляцию биотканей. Это касается различных лазеров с интенсивностью от 1 до 107 Вт/см2 и с продолжительностью облучения от миллисекунд до нескольких секунд. К ним относятся, например, газовый СО2-лазер (с длиной волны 10,6 мкм), Nd:YAG-лазер (1,064 мкм) и другие. Nd:YAG-лaзep — наиболее широко используемый твердотельный четырехуровневый лазер. Генерация осуществляется на переходах ионов неодима (Nd3+), введенных в кристаллы Y3A15O12 иттрий-алюминиевого граната (YAG).
Наряду с нагревом ткани происходит отвод части тепла за счет теплопроводности и тока крови. При температурах ниже 40 °С необратимые повреждения не наблюдаются. При температурах 60 °С и выше начинается денатурация белков, коагуляция тканей и некроз. При 100— 150 °С вызывается обезвоживание и обугливание, а при температурах свыше 300 °С ткань испаряется.

Когда излучение исходит от высокоинтенсивного сфокусированного лазера, количество выделяющегося тепла велико, в ткани возникает температурный градиент. В месте падения луча ткань испаряется, в прилегающих областях происходит обугливание и коагуляция (рис. 24.21). Фотоиспарение является способом послойного удаления или разрезания ткани. В результате коагуляции завариваются сосуды и останавливается кровотечение. Так сфокусированным лучом непрерывного СО2-лазера (l = 10,6 мкм) с мощностью около 2 • 103 Вт/см2 пользуются как хирургическим скальпелем для разрезания биологических тканей.
Если уменьшать длительность воздействия (10-9—10-6 с) и увеличивать интенсивность (выше 106 Вт/см2), то размеры зон обугливания и коагуляции становятся пренебрежимо малыми. Такой процесс называют фотоабляцией (фотоудалением) и используют для послойного удаления ткани. Фотоабляция возникает при плотностях энергии 0,01—100 Дж/см2.
При дальнейшем повышении интенсивности (1011 Вт/см2 и выше) возможен еще один процесс — «оптический пробой». Это явление заключается в том, что из-за очень высокой напряженности электрического поля лазерного излучения (сравнимой с напряженностью внутриатомных электрических полей) материя ионизуется, образуется плазма и генерируются механические ударные волны. Для оптического пробоя не требуется поглощения квантов света веществом в обычном смысле, он наблюдается также в прозрачных средах, например в воздухе.

1 В 1964 г. Н. Г. Басову, А. М. Прохорову и Ч. Таунсу за эти работы
была присуждена Нобелевская премия.
2 2 Название «лазер» является аббревиатурой от англ. Light Amplifica
tion by Stimulated Emission of Radiation (усиление света посредством вы
нужденного излучения).
3 3 На этой редуцированной схеме представлены только те уровни и переходы между ними, которые существенны для генерации лазерного излучения. На самом деле схема электронных уровней гораздо сложнее. На схеме не отражена ширина энергетических уровней. Так, короткоживу-щий уровень 3 является широким и поглощает большую часть спектра излучения лампы накачки.
4 Фотохимия изучает химические реакции, протекающие под действием света.
§ 24.9. Фотобиологические процессы. Понятия о фотобиологии и фотомедицине
Фотобиологическими называют процессы, которые начинаются с поглощения квантов света молекулами, а заканчиваются физиологической реакцией организма.
К фотобиологическим процессам относятся фотосинтез, зрение, загар и эритема кожи, фотопериодизм и многие другие.
Условно всякий фотобиологический процесс можно разбить на несколько стадий:
1) 1) поглощение кванта света молекулой;
2) 2) внутримолекулярные процессы размена энергии;
3) 3) межмолекулярные процессы переноса энергии электронно-возбужденного состояния (важны в некоторых фотобиологических процессах);
4) 4) первичный фотохимический акт, сопровождающийся образованием короткоживущих, нестабильных фотопродуктов, в него молекула вступает из нижнего синглетного S1 или триплетного Т1 возбужденных состояний;
5) 5) реакции нестабильных фотопродуктов, заканчивающиеся образованием стабильных продуктов;
6) 6) биохимические реакции с участием фотопродуктов;
7) 7) физиологический ответ на действие света.
Первые три стадии фотобиологических процессов одинаковы для фотохимических реакций и фотолюминесценции. Поэтому законы фотохимии имеют свои аналогии с законами люминесценции (см. § 24.6). Первичный фотохимический акт заключается в
химических изменениях молекулы (например, присоединении или отдаче электрона или водорода).
Особенностью биологического действия ультрафиолетового и видимого излучения (200—750 нм)1 является ярко выраженная зависимость биологического эффекта от длины волны излучения. Бактерицидные эффекты вызываются волнами в диапазоне 200— 315 нм, покраснение (эритема) кожи наиболее эффективно вызывается излучением с длиной волн 280—315 нм, зрительный эффект — 400—750 нм (видимый диапазон), лечение желтухи новорожденных — фиолетовым светом (около 400 нм). При фотосинтезе растения и фотосинтезирующие бактерии используют весь диапазон солнечного ультрафиолетового излучения, достигающего поверхности Земли (коротковолновая граница солнечного света, проходящего через атмосферу Земли, ~ 285 нм), видимого света, и даже ближнего инфракрасного излучения (иногда до 1000 нм).
Меняя длину волны, можно избирательно инициировать те или иные фотобиологические процессы2. Дело в том, что разные фотобиологические процессы начинаются с поглощения квантов света разными молекулами, в свою очередь положение полосы поглощения молекулы зависит от ее химической структуры (см. § 24.4).
Важной характеристикой воздействия света на биологические объекты является спектр фотобиологического действия — зависимость биологического эффекта от длины волны действующего света. Спектры действия позволяют определить, какая область спектра наиболее эффективно вызывает биологический процесс, а также определить природу молекул, ответственных за поглощение света в данном процессе.
Рассмотрим количественно начальные этапы этого процесса: поглощение света и первичную фотохимическую реакцию.
По аналогии с рассуждениями § 24.1, введем понятие эффективного сечения поглощения молекулой фотона s. Отличие от вывода закона Бугера—Ламберта—Бера заключается, по крайней мере, в следующем: во-первых, будем учитывать уменьшение числа активируемых молекул, так как воздействие света вызывает их химические превращения; во-вторых, рассмотрим достаточно тонкий слой разбавленного раствора, это позволит считать интенсивность света I0 постоянной и одинаковой по всей толщине слоя раствора.
Элементарное уменьшение концентрации dn молекул под действием света пропорционально:
— — концентрации п молекул;
— — эффективному сечению поглощения s;
— — времени облучения dt;
— — интенсивности света 103:
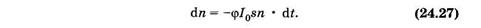
Здесь знак «-» означает уменьшение числа молекул со временем.
Коэффициент (jх называют квантовым выходом фотохимической реакции. Этот коэффициент показывает, какая часть молекул, которые поглотили фотоны, вступила в фотохимическую реакцию. Разделим переменные и проинтегрируем (24.27):
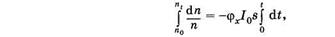
где п0 — начальная концентрация молекул, a ni — концентрация молекул в момент i. Получаем 
или
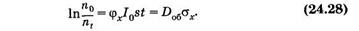
Здесь Iot = Do6 — доза облучения, a sjx = sх — эффективное сечение молекулы для фотохимического превращения, оно пропорционально вероятности такого взаимодействия фотона с молекулой, в результате которого произойдет фотохимическая реакция.
Для нахождения sх строят график зависимости ln n0/ni = f(Do6) и
по наклону прямой [см. (24.28)] определяют эту величину (рис. 24.22, б). Можно найти sх непосредственно на дозовой кривой фотолиза4 вещества (рис. 24.22, а)

где Do6.37% — доза облучения, при которой концентрация вещества уменьшилась в е раз, другими словами, осталось неразрушенными 37% молекул.
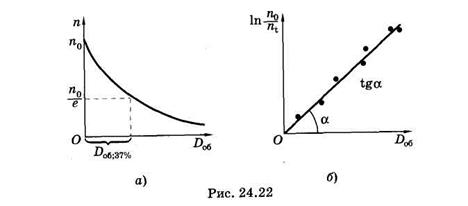
В фотохимии спектром действия называют зависимость sх(l). Эту зависимость можно найти, используя связь sх = sjx. Дело в том, что квантовый выход фотохимических реакций (подобно квантовому выходу флуоресценции, см. § 24.6) в растворах не зависит от длины волны действующего света, т. е. jх(l) = const. Физически это означает, что независимо от энергии возбуждения hv молекула сначала израсходует часть этой энергии, пока не перейдет в нижнее возбужденное состояние (см. § 24.6 и рис. 23.16), и только после этого сможет начать фотохимическое превращение. Учитывая это, можно заключить, что спектр действия jх(l) и спектр поглощения (см. § 24.4) — зависимость s(l) — имеют одинаковый вид, так как различаются только постоянным множителем jх. Такая особенность позволяет, сопоставляя спектр действия фотохимической реакции со спектрами поглощения содержащихся в объекте соединений, определить, какое из них поглощает фотоны, вызывающие фотохимические превращения.
Описанная методика определения спектров действия может быть применена к исследованию бактерицидного действия света. Сходство процессов при фотолизе молекул в растворе и при фотоинактивации бактерий в суспензии заключается в следующем. Под действием поглощенного кванта молекула либо совсем не изменится, либо превратится в фотопродукт, т. е. возможны только два исхода, причем вероятность фотолиза определяется квантовым выходом jх. Точно так же при поглощении кванта бактерией она либо останется живой, либо погибнет. Концентрацию жизнеспособных бактерий можно определить подобно концентрации неразрушенных молекул в растворе. Вероятность гибели бактерии при поглощении кванта определяется квантовым выходом бактерицидного эффекта и (так же как при фотолизе молекул) не зависит от длины волны действующего света. Поэтому если в формулы (24.27)—(24.29) вместо концентрации молекул подставить концентрацию бактерий, то можно найти ох для бактерицидного эффекта и построить спектр действия. Так, например, было установлено, что кривая гибели бактерий под действием УФ-излучения (спектр фотобиологического действия) подобна спектру поглощения нуклеиновых кислот, представляющему широкую неструктурированную полосу в диапазоне длин волн 200—315 нм с максимумом при 260 нм. Это дало основание сделать вывод, что гибель бактерий обусловлена повреждением именно нуклеиновых кислот. На этом основано использование в медицине для обеззараживания помещений ртутных бактерицидных ламп, излучающих монохроматический свет с длиной волны 254 нм, что соответствует максимуму спектра действия бактерицидного эффекта.
Сложнее дело обстоит в случае таких процессов, как эритема кожи. Эритема заключается в расширении кровеносных сосудов кожи, что видно по ее покраснению. Зависимость степени покраснения от дозы характеризуется наличием пороговой дозы (минимальной эритемной дозы, МЭД), вызывающей едва различимое глазом покраснение. Подпороговые дозы эритему не вызывают совсем. При увеличении дозы облучения степень покраснения растет пропорционально логарифму дозы. Здесь отсутствуют количественные показатели, подобные числу разрушенных молекул или погибших клеток, которые можно было бы использовать для расчета sх. Выход из положения был найден при введении следующего предположения. Если облучать кожу разными длинами волн и при этом подбирать каждый раз дозу так, чтобы возникающий эффект (степень покраснения) был одинаков, то можно думать, что одинаковая степень покраснения (стандартный эффект) является результатом одинаковых фотохимических повреждений. В качестве стандартного эффекта обычно выбирают минимальное покраснение, вызываемое МЭД. Величина МЭД является функцией длины волны действующего света. По аналогии с (24.29) было предложено определять величину эритемной эффективности как 1/МЭД. Предполагается, что 1/МЭД пропорциональна sх, подобно 1/-Do6;37% из выражения (24.29). Спектры действия эритемы представлены на рис. 24.23, кривая 1измерена через 8 часов после облучения, 2 — через 24 часа и 3 — через 10 суток. Выяснилось, что динамика развития, длительность существования и степень покраснения кожи сильно зависят от длины волны действующего света.

На этом основании в медицине весь диапазон УФ-излучения принято подразделять на три области: УФ-А (320— 400 нм), УФ-В (280—320 нм) и УФ-С (l < 280 нм). УФ-А-излучение наименее эффективно. УФ-В-излучение способно вызывать наиболее интенсивную и длительную эритему, переходящую при дозах более 10 МЭД в эдему (ожог кожи). УФ-С-излучение может вызвать только умеренное покраснение, ни при каких дозах не
переходящее в эдему. Регистрация спектров действия эритемы покатала, что данная реакция кожи является следствием суммирования двух или трех фотохимических процессов, каждый из которых по-разному зависит от длины волны действующего света. В случае других сложных фотобиологических процессов можно для регистрации спектров действия использовать величину биологической эффективности света (БЭС), обратную дозе облучения, вызывающей стандартный биологический эффект Do6 ст
Изучение спектров действия показало, что УФ-В-излучение наиболее эффективно вызывает не только эритему, но также пигментацию и рак кожи, кроме того, оно подавляет Т-клеточное звено иммунитета и вызывает многие другие эффекты у человека и животных. Отсюда понятно внимание, уделяемое состоянию озонового слоя атмосферы. Озон является естественным светофильтром, определяющим коротковолновую границу солнечного излучения, достигающего поверхности Земли. В ясный полдень на экваторе на высоте моря коротковолновая граница проходит вблизи 285 нм. Суммарно УФ-В-излучение составляет менее 1,5% энергии солнечного света, но обусловливает наиболее острые фотобиологические эффекты. Уменьшение озонового слоя резко увеличивает количество УФ-В-излучения, что крайне опасно для живых организмов.
Сопоставление спектров действия со спектрами поглощения содержащихся в биологическом объекте молекул позволяет определить, какие молекулы поглощают фотоны, запускающие исследуемый фотобиологический процесс. Такие фотобиологические процессы, как зрительный эффект, фотомутагенез, фотоканцерогенез, эритема и др., индуцируются под действием света, поглощаемого нормально содержащимися в объекте молекулами, например, зрительными пигментами, нуклеиновыми кислотами, белками и др. В некоторых случаях наблюдается резкое повышение светочувствительности биологических систем в результате попадания в них экзогенных (посторонних) молекул, способных поглощать ультрафиолет или видимый свет. Вещества, повышающие чувствительность биообъектов к свету, называют фотосенсибилизаторами, а инициируемые ими фотобиологические процессы — фотосенсибилизированными. Форма спектра действия такого процесса совпадает со спектром поглощения соответствующего фотосенсибилизатора.
Определение вида молекул, поглотивших свет, существенно потому, что свойства электронно-возбужденных молекул сильно отличаются от свойств тех же молекул в основном (невозбужденном) состоянии. Благодаря такому изменению свойств молекул и инициируются фотобиологические процессы.
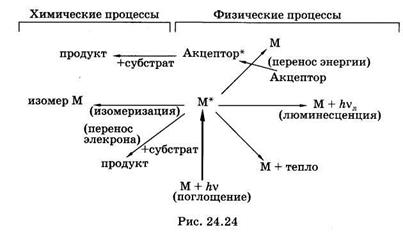
Молекула (М) обязательно избавляется от избыточной энергии, расходуя ее либо в физических процессах, либо в фотохимических реакциях. Основные пути расходования энергии возбужденных молекул (М*) показаны на рис. 24.24. Может произойти безызлуча-тельный переход энергии в тепло, либо излучение квантов люминесценции с возвращением молекулы в основное состояние (§ 24.6).
Все многообразие фотохимических реакций электронно-возбужденных молекул сводится к фотоизомеризации или переносу электрона между возбужденной молекулой и субстратом.
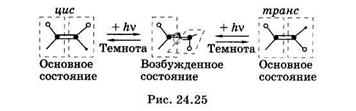
Фотоизомеризация — это изменение пространственной структуры молекул,осуществляющееся в электронно-возбужденном состоянии.Известно, что у органических молекул, находящихся в основном состоянии, невозможно вращение их частей вокруг двойных связей. Такие молекулы имеют плоскую цис- или торакс-конфигурацию (рис. 24.25). Это связано с особенностями  перекрывания p-орбиталей при образовании второй связи (см. рис. 23.15, б). Для того чтобы повернуть две части молекулы вокруг двойной связи, нужно уменьшить области перекрывания p-орбиталей, для этого нужно затратить значительную энергию (кривая с индексом So на рис. 24.26), такой процесс самопроизвольно произойти не может. Наименьшую энергию молекула имеет при перекрывании p-орбиталей, поэтому p-орбитали называют связывающими. При поглощении фотона и переходе в возбужденное состояние молекула сразу после перехода сохраняет плоскую конфигурацию основного состояния. Но возбужденные p*-орбитали (S1 или Т1 состояния на рис. 24.26) являются разрыхляющими: наименьшую энергию имеет конфигурация, в которой p-связь разрывается и две части молекулы поворачиваются вокруг s-связи на 90°. При возвращении молекулы в основное состояние она может претерпеть цис-тпранс- или транс-цис-изомеризицию; цис-транс-фотоизошеризащш пигмента ретиналя принадлежит ведущая роль в зрительной рецепции (см. § 24.10).
перекрывания p-орбиталей при образовании второй связи (см. рис. 23.15, б). Для того чтобы повернуть две части молекулы вокруг двойной связи, нужно уменьшить области перекрывания p-орбиталей, для этого нужно затратить значительную энергию (кривая с индексом So на рис. 24.26), такой процесс самопроизвольно произойти не может. Наименьшую энергию молекула имеет при перекрывании p-орбиталей, поэтому p-орбитали называют связывающими. При поглощении фотона и переходе в возбужденное состояние молекула сразу после перехода сохраняет плоскую конфигурацию основного состояния. Но возбужденные p*-орбитали (S1 или Т1 состояния на рис. 24.26) являются разрыхляющими: наименьшую энергию имеет конфигурация, в которой p-связь разрывается и две части молекулы поворачиваются вокруг s-связи на 90°. При возвращении молекулы в основное состояние она может претерпеть цис-тпранс- или транс-цис-изомеризицию; цис-транс-фотоизошеризащш пигмента ретиналя принадлежит ведущая роль в зрительной рецепции (см. § 24.10).
К фотохимическим превращениям молекулы, поглотившей фотон, приводят резкие изменения ее донорно-акцепторных свойств. Ввозбужденной молекуле освобождается электронная вакансия на верхней заполненной орбитали (So на рис. 23.16), в результате чего молекула становится акцептором электрона, способным вступать в реакции фотовосстановления с подходящими донорами. Примером такой реакции может служить открытая А. А. Красновским (1948) реакция фотовосстановления хлорофилла. Это открытие имело фундаментальное значение в познании процесса фотосинтеза. Наряду с этим в возбужденной молекуле появляется электрон на сравнительно высоко расположенной нижней свободной орбитали (S1 или Т1 на рис. 23.16). В результате этого молекула становится донором электрона и легко вступает в реакции фотоокисления. Так, возбужденные ароматические аминокислоты триптофан и тирозин способны отдавать электрон молекулам среды, что приводит к их ионизации.
Если рядом с возбужденной молекулой находится подходящий акцептор, то энергия может быть перенесена на него. Электронно-возбужденный акцептор может либо сам химически модифицироваться или вступить в реакцию с субстратом. Подобные реакции могут быть отнесены к фотосенсибилизированным.
Механизмы фотосенсибилизированных реакций крайне разнообразны. Практически удобно классифицировать их на два вида: нуждающиеся в присутствии кислорода и не нуждающиеся в нем. Фотобиологические эффекты, для осуществления которых требуется участие трех составляющих — света, кислорода и фотосенсибилизатора — принято называть фотодинамическими эффектами, а соответствующие фотосенсибилизаторы — фотодинамическими. Фотодинамические эффекты инициируются фотосенсибилизаторами из триплетного электронно-возбужденного состояния T1 (см. рис. 23.16).
Более детальная классификация фотосенсибилизированных реакций основана на природе реакционно-способных фотопродуктов, непосредственно реагирующих с субстратом. Рассмотрим этот вопрос на примере псораленов — фотосенсибилизаторов растительного происхождения, повышающих чувствительность биообъектов к УФ-А-излучению.
В реакциях типа I происходит перенос электрона (или водорода) между электронно-возбужденным фотосенсибилизатором и субстратом, сопровождающийся образованием свободных радикалов, которые взаимодействуют с молекулярным кислородом.
В реакциях типа II происходит перенос энергии от фотосенсибилизатора, находящегося в триплетном электронно-возбужденном состоянии T1 на молекулярный кислород по схеме:
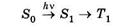
|
| — поглощение света и образование триплетного |
состояния фотосенсибилизатора;
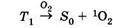
|
— перенос энергии и образование синглетного
электронно-возбужденного молекулярного кислорода. Образующийся при этом синглетный кислород 1О2 взаимодействует с субстратом, окисляя последний:
1О2 + субстрат -> окисленный субстрат.
В реакциях типа II фотосенсибилизатор работает подобно катализатору и в реакции не расходуется. Субстратами фотоокисления служат молекулы ДНК, белков, ненасыщенных липидов и другие.
В реакциях типа III участвуют электронно-возбужденные молекулы псораленов, предварительно в темноте встроившиеся в двуспиральную ДНК. При этом они ковалентно присоединяются к тимину, повреждая либо одну из нитей двуспиральной ДНК, либо образуя межнитевую сшивку в двуспиральной молекуле ДНК. Реакции типов I—IIIмогут осуществляться только в том случае, если субстрат облучается в присутствии фотосенсибилизатора. Это связано с коротким временем жизни реакционно-способных фотопродуктов. Так, время жизни синглетных и триплетных электронно-возбужденных состояний молекул составляет, соответственно, около 10-9 и 10-6 с, синглетного кислорода — около 10-6 с, свободных радикалов — микро- или миллисекунды. Невозможно фотомодифицировать субстрат, сначала отдельно облучив фотосенсибилизатор, а затем после выключения света добавив к нему субстрат.
Дата добавления: 2020-11-18; просмотров: 395;











