Кристаллические и аморфные тела. Полимеры и биополимеры
Отличительным признаком кристаллического состояния служит анизотропия — зависимость физических свойств (механичеких, тепловых, электрических, оптических) от направления.
Причина анизотропии кристаллов заключается в упорядоченым расположении атомов или молекул, из которых они построил, проявляющемся в правильной внешней огранке отдельных монокристаллов. Однако, как правило, кристаллические тела встречаются в виде поликристаллов — совокупности множеств сросшихся между собой, беспорядочно ориентированных отдельных маленьких кристалликов (кристаллиты). В этом случае анизотропия наблюдается в пределах кристаллитов.
Упорядоченность в расположении атомов или молекул кристалла обусловлена тем, что они размещаются в узлах геометрически правильных структур, образуя пространственную кристаллическую решетку. В зависимости от природы частиц, находящихся в узлах, и характера сил взаимодействия различают четыре типа кристаллических решеток: ионные, атомные, металлические и молекулярные.
В узлах кристаллической решетки ионного кристалла находятся ионы разных знаков. Силы взаимодействия между ними в основном кулоновские. Такой кристалл в целом рассматривается как одна молекула. Узлы решетки атомного кристалла заняты нейтральными атомами, между которыми действуют ковалентные связи. Во всех узлах металлической решетки расположены положительные ионы металлов. Между ними хаотически движутся электроны. Система ионов и электронов создает металлическую связь. В узлах кристаллической решетки молекулярного кристалла находятся ориентированные определенным образом молекулы, удерживаемые на своих местах силами межмолекулярного взаимодействия.
С энергетической точки зрения идеальный кристалл противоположен идеальному газу. В идеальном газе абсолютное значение энергии взаимодействия между атомами много меньше κT — средней энергии хаотического теплового движения. Наоборот, в кристалле вследствие больших сил взаимодействия абсолютное значение энергии взаимодействия много больше κT. Поэтому тепловое движение в кристаллах не может разрушить связь между частицами, вследствие чего они совершают малые колебания около положений равновесия.
Взаимодействие между частицами любого вида в кристалле выражается зависимостью потенциальной энергии Еп от расстоя  ния r между ними (рис. 8.1). Кривая не симметрична относительно минимума. Расстояние r0 между взаимодействующими частицами соответствует минимуму потенциальной энергии при Т = = 0 К. Пусть при температуре Т1 суммарная (кинетическая и потенциальная) энергия равна Е1. Это означает, что частица колеблется между точками А1 и B1. Среднее расстояние между двумя частицами r1 = (ОА1 + ОВ1)/2.
ния r между ними (рис. 8.1). Кривая не симметрична относительно минимума. Расстояние r0 между взаимодействующими частицами соответствует минимуму потенциальной энергии при Т = = 0 К. Пусть при температуре Т1 суммарная (кинетическая и потенциальная) энергия равна Е1. Это означает, что частица колеблется между точками А1 и B1. Среднее расстояние между двумя частицами r1 = (ОА1 + ОВ1)/2.
При Т2 > Т1 энергия частицы равна Е2 > Е1 и она колеблется между точками А2 и В2. Среднее расстояние между частицами равно г2 = (ОА2 + ОВ2)/2. Ввиду того что потенциальная кривая асимметрична, средние расстояния между частицами по мере нагревания увеличиваются: r0 < r1< r2< r3< ... при 0 К < Т1 < Т2 < Т3 < ..., , что и обусловливает тепловое расширение тел.
Основная макроскопическая особенность аморфных тел заключается в естественной изотропии их свойств и отсутствии определенной точки плавления, что обусловлено внутренним строением тел. Главной особенностью внутреннего строения тел, находящихся в аморфном состоянии, является отсутствие дальнего порядка, характерного для кристаллического состояния, т. е. строгой повторяемости в расположении атомов или групп атомов во всех направлениях вдоль всего тела.
Вместе с тем у вещества в аморфном состоянии (как и в жидком) существует ближний порядок, т. е. некоторый порядок в расположении смежных частиц. С расстоянием этот порядок уменьшается.
Обладая меньшей упорядоченностью внутреннего строения, аморфные тела в одинаковых условиях имеют большие, чем кристаллы, удельный объем, энтропию и внутреннюю энергию. Достаточно равновесное состояние эти тела образуют только при высокой температуре и малом давлении, что связано с установлением определенного расположения частиц и расстояний между ними. В соответствии с этим аморфные тела в зависимости от скорости внешнего воздействия могут оказаться упругими или текучими. Так, например, если кусок вара положить в сосуд, то по истечении большого промежутка времени он примет форму сосуда, т. е. проявит свойства текучести. Если же этот кусок ударить молотком, то он расколется как хрупкое тело.
Аморфное состояние свойственно веществам самой различной химической природы. При малом давлении и высокой температуре вещества в этом состоянии весьма подвижны: низкомолекулярные являются жидкостями, высокомолекулярные оказываются в высокоэластическом состоянии. С понижением температуры и ростом давления подвижность аморфных веществ уменьшается и все они становятся твердыми телами. Твердое аморфное состояние иначе называют стеклообразным.
Полимерами называют вещества, молекулы которых представляют собой длинные цепи, составленные из большого числа атомов или атомных группировок, соединенных химическими связями. Особенность химического строения полимеров обусловливает и их особые физические свойства.
Наиболее резко отличаются полимеры от низкомолекулярных веществ в механических свойствах. Известно, что для твердых тел характерны большие прочности при малых обратимых деформациях. Жидкости обладают способностью к неограниченной деформации при весьма малой прочности. Полимеры — это материалы, механические свойства которых являются сочетанием свойств, твердых тел и жидкостей; они достаточно прочны и вместе с тем способны к достаточно большим обратимым деформациям.
К полимерным материалам относят почти все живые и растительные материалы, такие как шерсть, кожа, рог, волос, шелк, хлопок, натуральный каучук и т. п., а также всякого рода синтетические материалы — синтетический каучук, пластмассы, волокна и др.
Большинство природных полимерных материалов представляет собой белковые вещества; простые белки — альбумин, глобулин; сложные — казеин, кератины и коллаген. В агар-агаре содержится до 85% углеводов, главным образом полисахаридов, которые также являются полимерами.
Кроме механических, полимеры обладают и другими особыми свойствами. Так, например, их растворы имеют повышенную вязкость; упругость пара растворителя над раствором меньше, а осмотическое давление больше, чем должно быть для идеальных растворов. Полимеры способны сильно набухать в жидкостях.
Длинноцепочечное строение молекул полимеров способствует образованию пленок и волокон.
В настоящее время полимеры все шире используются в качестве диэлектриков.
 |
 Простейшим органическим полимером является полиэтилен, полимерная цепь или макромолекула которого составлена из многократно повторяющихся мономерных звеньев, образующихся при соединении молекул этилена:
Простейшим органическим полимером является полиэтилен, полимерная цепь или макромолекула которого составлена из многократно повторяющихся мономерных звеньев, образующихся при соединении молекул этилена:
Полиэтилен — представитель линейных полимеров. Линейными называют полимеры, макромолекулы ко-горых состоят из длинных одномерных цепей (рис. 8.2, а; А — мономерное звено). Разветвленный полимер, кроме основной цепи, имеет боковые ответвления — боковые цепи (рис. 8.2, б).
Полимеры, построенные из длинных цепей, соединенных друг с другом в пространственную сетку, являются сетчатыми, или пространственными, а построенные из одинаковых полимеров — гомополимерами. Полимерные соединения, цепи которых состоят из различных мономерных звеньев, относят к гетерополимерам.
Макромолекула полимера не является жесткой. Вследствие теплового движения или под действием внешнего поля ее пространственная форма может изменяться. Эти изменения называют конформационными превращениями.
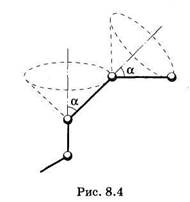
Предельно гибкой является свободносочлененная цепь (рис. 8.3). В такой цепи углы между валентными связями не фиксированы и вращение вокруг них свободное. В реальных полимерных цепях валентные углы а имеют определенное значение (рис. 8.4). Это приводит к зависимости положения одного звена цепи от положения предыдущего. Такая цепь принимает меньшее число конформаций, чем свободносочлененная, но и она способна сильно изгибаться.
 Макромолекулы в результате теплового движения звеньев принимают разнообразные конформации, из них крайними являются, с одной стороны, жесткая прямая палочка, с другой стороны, предельно гибкая цепь, свернувшаяся в клубок (глобула). Макромолекулы могут достигать огромных размеров, обладая относительной молярной массой от нескольких тысяч до сотен миллионов и даже миллиарда. Из-за большого размера молекул полимера температура кипения его чрезвычайно высока (необходима очень большая энергия для испарения огромных молекул). Отсюда у всех полимеров температура разложения ниже температуры кипения и газовое состояние у них не реализуется.
Макромолекулы в результате теплового движения звеньев принимают разнообразные конформации, из них крайними являются, с одной стороны, жесткая прямая палочка, с другой стороны, предельно гибкая цепь, свернувшаяся в клубок (глобула). Макромолекулы могут достигать огромных размеров, обладая относительной молярной массой от нескольких тысяч до сотен миллионов и даже миллиарда. Из-за большого размера молекул полимера температура кипения его чрезвычайно высока (необходима очень большая энергия для испарения огромных молекул). Отсюда у всех полимеров температура разложения ниже температуры кипения и газовое состояние у них не реализуется.
Следовательно, полимеры находятся в конденсированном состоянии: жидком или твердом. Среди твердых полимеров следует различать аморфные и кристаллические.
Аморфный полимер в высокоэластическом состоянии (см. § 8.3) может сильно деформироваться (до 1000%), его деформация обратима, необратимое течение отсутствует. В этом смысле высокоэластическое состояние — промежуточное между жидким и твердым. Высокоэластическое состояние полимера возникает вследствие гибкости его макромолекул.
Макромолекулы во всех состояниях полимеров всегда более или менее упорядочены, что приводит к надмолекулярным структурам. Известно, что полимеры характеризуются большим многообразием надмолекулярных структур не только в кристаллическом, но и в аморфном состоянии. Первичными элементами этих структур являются полимерные молекулы, либо свернутые в глобулы, либо развернутые в линейную макромолекулу. При контакте глобул могут образоваться глобулярные структуры, содержащие большое число молекул, иногда до 1000. При контакте развернутых макромолекул возникают продолговатые пачки (рис. 8.5), которые имеют флуктуационную природу — в одних местах исчезают, в других — появляются, но вместе с тем существуют довольно длительно.
Простейшие первичные надмолекулярные структуры — пачки полимерных цепей — наблюдают как в некристаллических, так и в кристаллических полимерах. При кристаллизации пачки складываются в «ленты». На рис. 8.6 изображены выпрямленная (а) и сложенная в ленту (б) пачки. Стремление к уменьшению поверхностного натяжения приводит к складыванию лент в пластины (рис. 8.7) и образованию сферолитов (рис. 8.8) или единичных кристаллов (рис. 8.9, единичный кристалл вируса некроза табака).
Многочисленные надмолекулярные структуры разделены академиком В. А. Каргиным на четыре основных типа: глобулярный (свернуты одиночные молекулы или группы молекул), полосатый (структуры всех полимеров в высокоэластическом состоянии), фибриллярный (линейные пачки или их совокупности, сохраняющие продолговатую форму), крупноструктурный (сферолиты, единичные кристаллы и т. п.).

Формы и размеры надмолекулярных структур оказывают большое влияние на прочность полимеров. Так, например, образец с малыми сферолитами обладает высокой прочностью и хорошими эластическими свойствами, образцы же с крупными сферолитами разрушаются хрупко.
Как видно из вышеизложенного, полимерные материалы характеризуются широким набором ценных физико-химических свойств, что позволяет использовать их в различных областях науки и техники, а также в медицине.
Из полимеров типа полиэтилена, поливинилхлорида и др., легко обрабатываемых давлением, изготовляют различные медицинские инструменты и приспособления. Тефлон, капрон и лавсан, милар, силастиковый полимер обладают высокой химической стойкостью, вследствие чего их используют при изготовлении протезов внутренних частей организма (кровеносных сосудов, клапанов сердца, сухожилий, вживляемых глазных линз и т. п.). Раствор полимера поливинилпирролидона — хороший заменитель кровяной плазмы.
В настоящее время в искусственной почке применяются целлофановые мембраны. Такие мембраны задерживают белок и клетки, точные элементы крови. Проводятся эксперименты по созданию искусственных легких с силиконовыми мембранами, обладающими высокой пропускной способностью по отношению к кислороду и диоксиду углерода.
Большой интерес для медицины представляют тканевые клеи, например алкил-α-цианокрилаты, n-бутил-α-цианокрилат, быстро полимеризующиеся в пленку, которые используют для закрытия ран без наложения швов.
К высокомолекулярным соединениям относятся также биополимеры, являющиеся структурной основой всех живых организмов и играющие главную роль в процессе их жизнедеятельности, — это
 |
белки, нуклеиновые кислоты, полисахариды, гликопротеиды, липопротеиды, гликолипиды и др.
Так, молекула белка состоит из одной или нескольких полипептидных цепей, образовавшихся в результате поликонденсации аминокислот. При объединении аминокислот в белковую цепь образуются пептидные связи — NH —СО—, строение которых было установлено Полингом и Кори методом рентгеноструктурного анализа (см. § 19.7). Состав аминокислот и их последовательность представляет собой первичную структуру белка, имеющую определяющее значение для его функций. Это подтверждается двумя группами фактов. Во-первых, различиями и сходством структур однотипных белков разных видов и, во-вторых, патологическими изменениями функций белков при замещениях (мутационных) аминокислотных остатков. Мутации выражаются в замещении аминокислотных остатков. В результате искажение всегда имеет серьезные биологические последствия. Эти явления детально изучены на гемоглобине.
Известен ряд наследственных заболеваний крови — анемий. При так называемой серповидноклеточной анемии, распространенной в некоторых районах Африки, Юго-Восточной Азии, Средиземноморья, эритроциты имеют форму серпов. В этом случае гемоглобин имеет структуру, подобную кристаллу. В результате эритроциты слипаются и подвергаются гемолизу — распаду. Тяжелые нарушения кровообращения, вызванные этим заболеванием, зачастую приводят к смерти в раннем возрасте.
Были обнаружены различия подвижности гемоглобинов при электрофорезе в норме и при анемии, что объясняется различием в аминокислотном составе и тем самым в числе заряженных групп. Болезни гемоглобина назвали молекулярными. Оказалось, что отличие аномальных гемоглобинов от нормального определяется замещением всего лишь одного остатка в белковой цепи.
Нуклеиновые кислоты представляют собой еще один важнейший тип биополимеров. Они служат обязательными участниками синтеза белков. Основная цепь нуклеиновой кислоты состоит из чередующихся звеньев фосфорной кислоты и сахара — рибозы в рибонуклеиновой кислоте (РНК) и дезоксирибозы в дезоксирибонуклеиновой кислоте (ДНК). В этом смысле основные цепи РНК и ДНК лишены первичной структуры, они являются монотонным орнаментом, но не текстом. Однако к сахарам присоединены так называемые азотистые основания, которые уже не повторяют друг друга. В целом, схема цепи нуклеиновой кислоты имеет следующий вид:
 Азотистое основание Азотистое основание
Азотистое основание Азотистое основание
Сахар Фосфат Сахар Фосфат
Последовательность азотистых оснований в нуклеиновой кислоте несет важную биологическую информацию. Определить первичную структуру нуклеиновой кислоты значительно сложнее, чем белка. Нуклеиновые кислоты являются асимметричными молекулами и вращают плоскость поляризации поляризованного света вправо (см. § 20.4).
Углеводы, полисахариды, также относятся к биополимерам. Полисахаридные цепи построены из моносахаридных звеньев, имеющих в мономерном состоянии формулу С6Н12О6. В отличие от нуклеиновых кислот, первичная структура полисахаридов не несет какой-либо биологической информации. Их размеры и разветвленность варьируют в широких пределах, молекулы не имеют определенной длины. В целом, полисахариды играют важную "роль в наружных мембранах некоторых клеток, участвуют в образовании клеточных оболочек бактерий многих видов. В мембранах полисахариды находятся в комплексах с белками и липидами — жировыми веществами, неизменно присутствующими в наружных и внутренних мембранах. Мембраны образованы комплексами белков с липидами и в ряде случаев с полисахаридами (см. § 11.1).
Жидкие кристаллы
Жидкими кристаллами называют вещества, которые обладают свойствами и жидкостей, и кристаллов.
По своим механическим свойствам эти вещества похожи на жидкости — они текут. По оптическим свойствам жидкие кристаллы ведут себя как анизотропные тела — кристаллы: вращают плоскость поляризации, обнаруживают двойное лучепреломление и т. п. Чаще всего жидкокристаллические свойства вещество проявляет в определенном температурном интервале, выше которого оно находится в аморфно-жидком состоянии, ниже — в твердо-кристаллическом.
Двойственность физических свойств обусловлена внутренним строением жидких кристаллов. Взаимное расположение молекул в них является промежуточным между аморфным состоянием, в котором полностью отсутствует дальний порядок, и твердым кристаллическим, в котором существует как дальний порядок в расположении центров молекул, так и упорядоченность в ориентации молекул. Жидкокристаллическое состояние наблюдается у веществ, молекулы которых имеют вытянутую форму в виде палочки или удлиненной пластинки. Такая форма молекул приводит к возможности упорядочения их ориентации.
По характеру молекулярной упорядоченности различают нематические и смектические жидкие кристаллы. В нематических жидких кристаллах молекулы ориентированы параллельно (рис. 8.10, а), но их центры расположены беспорядочно. Смектические кристаллы состоят из параллельных слоев, в которых расположение молекул упорядочено (рис. 8.10, б). Особый класс составляют кристаллы холестперического типа. Молекулы в таких кристаллах, как и в смектических, собраны в слои. Однако внутри каждого слоя параллельное расположение осей молекул напоминает нематическое состояние (рис. 8.10, в). Между слоями также имеется упорядочение: при переходе к соседним слоям изменяется на небольшой угол общая ориентация данного слоя по отношению к общей ориентации предыдущего слоя (наблюдается винтовая закрученность молекулярной структуры).
Молекулярная структура холестерических жидких кристаллов очень чувствительна к любому малейшему внешнему воздействию. Малое возмущение может нарушить слабые межмолекулярные силы, что приводит к заметным изменениям оптических свойств. Так, температура оказывает большое влияние на цвет кристалла, в зависимости от температуры он может быть любого цвета — от фиолетового до красного. Такие свойства жидких кристаллов используют для измерения изменений температуры различных участков тел.
В медицине это позволяет фиксировать расположение вен, артерий и других образований, имеющих иную теплоотдачу, чем окружающие среды. Жидкокристаллические вещества также применяются в различных температурно-чувствительных сигнальных устройствах.
Молекулярная структура жидких кристаллов, а следовательно, и их оптические свойства изменяются в присутствии ничтожных количеств паров некоторых химических веществ.
Это позволяет использовать жидкие кристаллы для обнаружения малых количеств (следов) этих веществ.
 |
На изменении оптических свойств жидких кристаллов под воздействием электрического поля основано применение их в приборах и часах в качестве цифровых индикаторов.
Исследование жидких кристаллов в живых организмах — огромная, малоизученная, но чрезвычайно перспективная область.
Дата добавления: 2020-11-18; просмотров: 622;











