Окислительно-восстановительные реакции
Все химические реакции можно разделить на два типа: протекающие без изменения и с изменением степеней окисления атомов, входящих в состав реагирующих веществ.
К первому типу реакций (I) следует отнести реакции разложения, синтеза веществ, обмена, в т.ч. нейтрализации, комплексообразования:
СаСО3 = СаО + СО2 (I)
Реакции второго типа осуществляются за счет перераспределения электронной плотности ( а иногда и полного перехода одного или нескольких электронов) между атомами реагентов, что проявляется в изменении степени окисления соответствующих элементов. Например,
+1 -2 0 0
2Ag2O = 4Ag + O2
К окислительно-восстановительным (ОВР) относят реакции, в которых изменяются степени окисления одного или нескольких элементов. ОВР многочисленны и многообразны (см. презентацию). Следует вспомнить понятие степень окисления (см. тему строение атома) и валентность.
Степень окисления – число, характеризующее формальный заряд атома элемента в соединении, вычисленный из предположения, что валентные электроны переходят к атомам с большей относительной электроотрицательностью (ОЭО) и что все связи между атомами в молекуле ионные. Принимает положительные, отрицательные и нулевое значения.
Валентность характеризует способность атомов образовывать химические связи с атомами других элементов. Имеет всегда положительное значение и изображается чертой (одна электронная пара).

В данном случае валентность совпадает со степенью окисления. Однако, это бывает не всегда. Например, в тиосерной кислоте H2S2O3
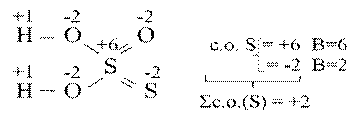
Н2, HF – валентность водорода равна 1 в обоих соединениях, а степени окисления 0 и +1.
Постоянную степень окисления имеют:
– атомы щелочных металлов в соединениях +1;
– атомы щелочноземельных металлов в соединениях +2;
– водород в бинарных соединениях с металлами (гидридах) –1, во всех остальных соединениях +1;
– кислород –2 (кроме пероксидов-соединений, содержащих группу –О–О–, где степень окисления –1);
– галогены в бинарных соединениях с металлами и водородом –1.
K+1N+ХO 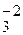
+1+Х+3(–2)=0
Х= +5
При записи ОВР обычно показывают, сколько электронов отдано или приобретено в процессах окисления-восстановления.
Окислением называется процесс отдачи электронов атомами, ионами, молекулами. Частицы, отдающие электроны, называются восстановителями.
Cao - 2 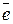 → Ca+2,
→ Ca+2,
Восстановление – процесс присоединения электронов атомами, ионами, молекулами. Частицы, присоединяющие электроны, называются окислителями.
Al+3 + 3 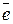 → Al0
→ Al0
Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем.
Дата добавления: 2020-11-18; просмотров: 494;











