Составление уравнений окислительно-восстановительных реакций. Метод электронного баланса.
Для уравнивания частей ОВР существует метод электронного баланса.
NaNO2+H2SO4+KMnO4®NaNO3+MnSO4+K2SO4+ H2O
Алгоритм действия:
Во-первых, в уравнении, определяют элементы, меняющие степень окисления в левой и правой частях.
Na N+3O2+H2SO4+KMn+7O4 ® NaN+5O3+ Mn+2SO4 + K2SO4 + H2O
Во-вторых, составляются электронные схемы и определяются коэффициенты перед окислителем и восстановителем.
1) составляются электронные уравнения
N+3 – 2 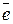 → N+5
Mn+7 + 5 → N+5
Mn+7 + 5 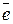 → Mn+2 → Mn+2
|
2) т.к. числа электронов, отдаваемых восстановителем и принимаемых окислителем всегда равны, то находят дополнительные множители и указывают характер процессов
| восстановитель окисление | N+3 – 2 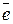 → N+5 → N+5
| |
| окислитель восстановление | Mn+7 + 5 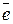 → Mn+2 → Mn+2
|
3) полученные множители (коэффициенты перед окислителем и восстановителем) переносят в общее уравнение
5Na N+3O2 + H2SO4 + 2KMn+7O4 ® 5NaN+5O3 + 2Mn+2SO4 + K2SO4 + H2O
В-третьих, остальные коэффициенты подбираются в последовательности:
– уравнивается число атомов металлов (кроме окислителя и восстановителя);
– уравнивается число атомов неметаллов (кроме окислителя и восстановителя);
– уравнивается число атомов водорода;
– проверка по кислороду – число атомов кислорода в левой и правой частях уравнения должно быть одинаковым.
5Na N+3O2 + 3H2SO4 + 2KMn+7O4 ® 5NaN+5O3 + 2Mn+2SO4 + K2SO4 + 3H2O
30 [O] = 30[O]
Типы ОВР
Межмолекулярная ОВР – реакция, в которой в качестве окислителя и восстановителя выступают частицы разных веществ.
Mn+4O2 + 4HBr –1 = Mn+2Br2 + Br 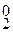 + 2H2O
ок-ль в-ль + 2H2O
ок-ль в-ль
|
Реакция диспропорционирования (самоокисления-самовосстановления) – ОВР, в которой в качестве окисления и восстановления выступают атомы одного и того же элемента, входящие в состав разных молекул одного и того же вещества.
| N+4O2 + H2O → HN+3O2 + HN+5O3 | ||
N+4 + 1 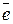 = N+3 (ок-ль) = N+3 (ок-ль)
| ||
N+4 – 1 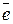 = N+5 (в-ль) = N+5 (в-ль)
|
Внутримолекулярная ОВР – реакция, в которой в качестве окислителя и восстановителя выступают атомы разных элементов одной и той же молекулы вещества.
2KCl+5O 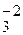 =2KCl–1 + O
=2KCl–1 + O 
ок-ль в-ль
ОВР с участием
Азотная кислота HNO3.
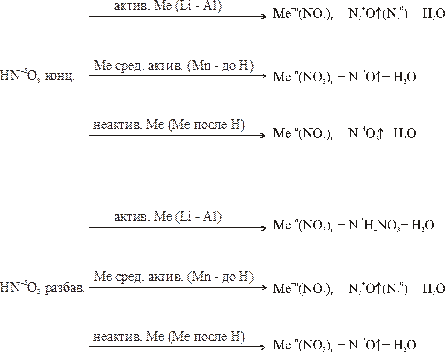
Серная кислота H2SO4.
1. Разбавленная серная кислота. Окислителем является ион водорода. Металлы, стоящие в ряду напряжений до водорода, вытесняют его из разбавленной серной кислоты.
Mg + H  SO4 ® MgSO4 + H
SO4 ® MgSO4 + H 
2. Концентрированная серная кислота. Окислителем является ион серы +6. продукт восстановления зависит от активности металла.
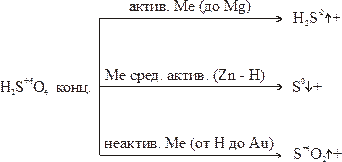
Перманганат калия KMnO4. В зависимости от среды перманганат-ион восстанавливается:
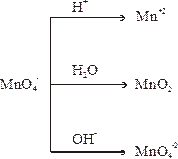
| Бесцветный ион Нерастворимый оксид бурого цвета Манганат-ион зеленого цвета |
Дата добавления: 2020-11-18; просмотров: 575;











