Реакции восстановления
Эти реакции лежат в основе многочисленных методов получения золей золота и серебра при взаимодействии солей этих металлов с различными восстановителями: Фосфором (Фарадей), таннитом (Оствальд), формальдегидом (Зигмогди), ацетоном (Девис), например:
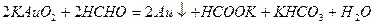
Реакция окисления
Они широко распространены в природе. Примером таких процессов является образование золя при взаимодействии сероводорода, растворенного в гидротермальных водах, с кислородом.
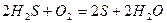
Гидролиз солей
Процессы гидролиза солей широко распространены в природе и имеют важное значение в технике. Эти процессы применяются для очистки сточных вод. Высокая удельная поверхность образующихся при гидролизе гидроксидов позволяет эффективно адсорбировать примеси. Примером является реакция гидролиза хлорного железа.
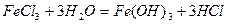
В природных условиях часто протекает реакция гидролитического окисления растворимых солей железа с образованием гидроксида железа. На большой глубине при отсутствии кислорода эта реакция не идет и вода, содержащая 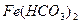 , прозрачны. На воздухе быстро протекает гидролитическое окисление по схеме:
, прозрачны. На воздухе быстро протекает гидролитическое окисление по схеме:
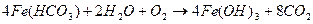
Эта реакция приводит к бурой окраске болот и к выпадению бурого осадка 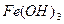 при стоянии вначале прозрачной воды из водопроводной сети, если вода содержит хорошо растворимый
при стоянии вначале прозрачной воды из водопроводной сети, если вода содержит хорошо растворимый 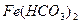 .
.
При физической конденсации образование новой фазы обычно связаны с изменением температуры или давления в системе.
Конденсация паров
Сущность метода заключается в том, что в газообразной системе при изменении температуры давление пара может стать выше равновесного давления пара над жидкостью или твердым телом и в газообразной фазе возникает новая жидкая или твердая фаза. Система становится гетерогенной, образуются аэрозоли (туман, дым). Путем испарения и конденсации паров в потоке несущего газа получают коллоидные частицы (наночастицы) металлов, углерода, кремния. Наночастицы осаждают на подложку при изменении температуры стенок камеры. В момент плавления для стабилизации наночастиц вводят поверхностно-активные вещества.
Дата добавления: 2020-11-18; просмотров: 568;











