Понятия обратимых и необратимых процессов 1 глава
Все процессы, протекающие в системах, могут являться обратимыми и необратимыми.
Обратимым называется процесс, переводящий систему из одного состояния (1) в другое (2) (рис. 2.1), причем обратный переход из (2) к (1) происходит таким образом, что система проходит через все те же промежуточные состояния, как и при прямом процессе.
Всякий медленно протекающий процесс следует считать обратимым. Обратимые процессы являются некоторой идеализацией. Однако на практике можно подойти достаточно близко к осуществлению обратимых процессов.

Рис. 2.1. Схема перехода системы из состояния 1 в состояние 2
Обычно всякий процесс, переводящий физическую систему из одного состояния в другое, протекает всегда таким образом, что его нельзя повести в обратном направлении так, чтобы система проходила через все те же промежуточные состояния, но только в обратном порядке. Такое свойство процесса называется необратимостью, и все процессы, протекающие во всех видах систем, являются необратимыми.
2.1.2. Внутренняя энергия систем
Системы могут обладать запасом внутренней энергии. Внутренней энергией какого-либо тела называется энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле сил. Так, например, при определении внутренней энергии некоторой массы газа не должна учитываться энергия движения газа вместе с сосудом и энергия, обусловленная нахождением газа в поле сил земного притяжения. Таким образом, в понятие внутренней энергии включают кинетическую энергию хаотического движения молекул, потенциальную энергию взаимодействия между молекулами и внутримолекулярную энергию.
Внутренняя энергия является функцией состояния системы. Это означает, что каждый раз, когда система оказывается в данном состоянии, ее внутренняя энергия принимает присущее этому состоянию значение, независимо от предыстории системы.
В идеальном газе взаимодействие между молекулами отсутствует, поэтому внутренняя энергия складывается из энергии отдельных молекул.
Если газ состоит из отдельных молекул, то полную энергию газа мжно найти по формуле
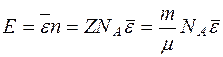 ;
;  (2.1)
(2.1)
где n - число молекул;
μ – молекулярный вес;
NА = 6,022·1023 моль-1- число Авогадро;
m – масса молекулы;
 - средняя энергия газа, приходящаяся на одну молекулу.
- средняя энергия газа, приходящаяся на одну молекулу.
Согласно гипотезе, что энергия поступательного движения газа распределяется равномерно по степеням свободы, получим:
 . (2.2)
. (2.2)
для одного моля 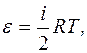 где i - число степеней свободы, то есть число независимых координат при равномерном распределении энергии в декартовой системе координат.
где i - число степеней свободы, то есть число независимых координат при равномерном распределении энергии в декартовой системе координат.
Внутренняя энергия системы может изменяться в основном за счет двух процессов:
1) в результате совершения работы А, например, над газом;
2) сообщения системе определенного количества тепла.
Совершение работы, как правило, сопровождается перемещением внешних тел, воздействующих на систему (рис. 2.2).

Рис. 2.2. Цилиндр с поршнем, заполненный идеальным газом
По третьему закону Ньютона газ при этом совершает над поршнем работу
А= - А'. (2.3)
Сообщенное системе тепло вызовет изменение внутренней энергии, не будет связано с перемещением тел и, следовательно, не будет связано с совершением над телом работы, то есть работа относится ко всей совокупности молекул, из которых состоит тело. Сообщение тепла вызовет изменение внутренней энергии. В этом случае изменение внутренней энергии будет обусловленно тем, что отдельные молекулы нагретого тела совершат работу над отдельными молекулами тела, нагретого меньше. Совокупность макроскопических процессов (то есть захватывающих не все тело, а отдельные его молекулы) приводит к передаче энергии от тела к телу и носит название теплопередачи, а переданная путем теплопередачи энергия определяется количеством тепла Q, отданным одним телом другому. Следовательно, приращение внутренней энергии системы должно быть равно сумме совершенной над системой работы А и количества сообщенного системе тепла:
U2-U1=Q+A', (2.4)
где U1 и U2 - начальные и конечные значения внутренней энергии.
Обычно вместо работы А', совершаемой внешними телами над системой, рассматривают работу А= - А', совершаемую системой над внешними телами. Следовательно,
Q=U2-U1+A. (2.5)
Уравнение (3.5) выражает закон сохранения энергии и представляет собой первое начало термодинамики.
При вычислении совершаемой системой работы или полученного системой тепла обычно приходится разбивать рассматриваемый процесс на ряд элементарных процессов, каждый из которых соответствует малому изменению параметров системы. Поэтому, чтобы произвести вычисление, необходимо продифференцировать выражение (3.5). Получим
dQ=dU+dA. (2.6)
2.2. Понятие теплоемкости. Применение первого начала термодинамики к газовым законам
Теплоемкостью С какого-либо тела называется величина, равная количеству теплоты, которое нужно сообщить телу, чтобы повысить его температуру на 1 °С, которая измеряется в Дж/град.
Теплоемкость киломоля вещества обозначается С и равна [Дж/(град·киломоль)]. Теплоемкость единицы массы вещества называется удельной теплоемкостью, обозначается с и имеет размерность [Дж/(град·кг)].
Между теплоемкостью киломоля вещества и удельной теплоемкостью того же вещества имеется очевидное соотношение: с=С/μ.
Если нагревание тела происходит при постоянном объеме, то имеем СV, при постоянном давлении - СP.
2.2.1. Изохорический процесс
Если нагревание системы происходит при постоянном объеме, то V=const, и давление изменяется по закону Шарля: 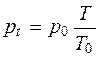 .
.
В этом случае газ не совершает работы над внешними телами и, следовательно, согласно первому началу термодинамики, все тепло идет на изменение внутренней энергии тела. В этом случае:
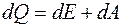 ;
;
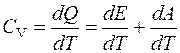 =>
=> 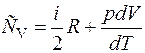 ; (2.7)
; (2.7)
 , (2.8)
, (2.8)
где i – число степеней свободы.
Из данного выражения видно, что теплоемкость газа при постоянном объеме оказывается постоянной величиной, независящей от параметров состояния газа, в частности от температуры.
2.2.2. Изобарический процесс
Если нагревание происходит при постоянном давлении (p = const), то газ будет расширяться, совершая работу над внешними силами (положительную).
 ;
;
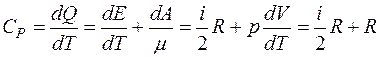 ; (2.9)
; (2.9)
или, с учетом формулы (3.8),
CP=CV+R; A=R=CP-CV. (2.10)
Таким образом, работа, которую совершает киломоль газа при повышении его температуры на 1 °С при постоянном давлении, оказывается равной универсальной газовой постоянной или разности удельных теплоемкостей при постоянном давлении и объеме.
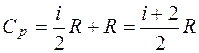 ;
;
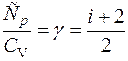 , (2.11)
, (2.11)
где γ - определяется числом и характером степеней свободы молекулы. (у одноатомной молекулы i=3.
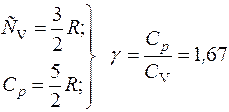 .
.
Например, у одноатомных молекул (гелий) γ=1,67; у двухатомных - γ =1,4; с числом атомов три и более - γ=l,33; у кислорода - γ= 1,4; у окиси углерода - γ=1,31.
2.2.3. Изотермический процесс
При изотермическом процессе T=const, dT=0.
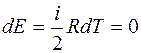 ,
,  . (2.12)
. (2.12)
Это значит, что вся внутренняя энергия идеального газа остается неизменной, и все подводимое извне тепло расходуется на работу, которую газ совершает, расширяясь, против внешнего давления. Несмотря на подводимое к телу тепло, "нагреваемый" газ не нагревается. Аналогично вело бы себя тело бесконечно большой массы и, следовательно, с большой теплоемкостью:
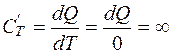 . (2.13)
. (2.13)
1. При изотермическом процессе (T=const) газ подчиняется закону Бойля-Мариотта. Кривая p=f(V) называется изотермой (рис. 3.3).
2. Работа, совершаемая при изотермическом расширении идеального газа, представлена на (рис. 2.3,а) в виде заштрихованного участка.
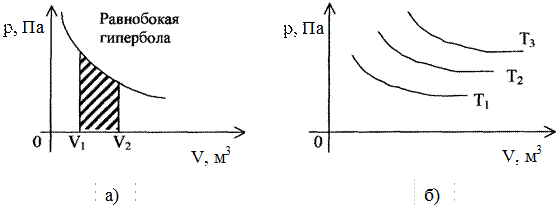
Рис. 2.3. Изотермы: а - площадь, характеризующая работу при изотермическом процессе; б - при разных температурах
 ;
; 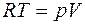 ;
; 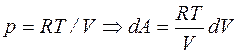 . (2.14)
. (2.14)
Проинтегрировав последнее уравнение, получим
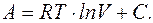
При A=0, 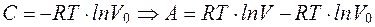 , или
, или
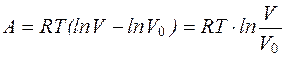 . (2.15)
. (2.15)
Уравнение (2.15) определяет работу, совершаемую системой при изотермическом процессе.
2.2.4. Адиабатический процесс
Если по каким-то причинам теплообмен с окружающей средой не осуществляется, то процесс называется адиабатическим:
 ;
; 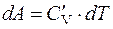 .
.
Подобный случай можно наблюдать, если газ заключен в непроводящую тепло оболочку или же если процесс происходит настолько быстро, что никакой заметный теплообмен не успевает осуществиться. Таким образом, при адиабатическом процессе расширения или сжатия газа совершается внешняя работа исключительно за счет изменения запаса внутренней энергии. Причем, если внешняя работа положительна, газ расширяется, совершает работу; если изменение запаса внутренней энергии отрицательно, газ охлаждается.
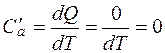 .
.
Найдем уравнение адиабаты:
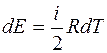 ;
; 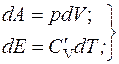
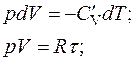
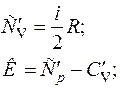
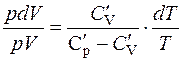 ;
; 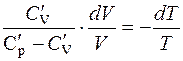 . (2.16)
. (2.16)
Тогда  ;
;
 .
.
Проинтегрируем последнее уравнение, получим
 .
.
Уравнение адиабаты будет
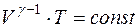 . (2.17)
. (2.17)
Тогда
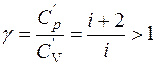 . (2.18)
. (2.18)
Это значит, что при изменении величины объема в несколько раз, 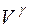 изменяется значительней. Поэтому давление изменится гораздо больше, чем при изотермическом процессе. При одинаковых начальных условиях P0, V0, T0 и одинаковом расширении газа (от V1 до V2) работа, совершаемая газом в адиабатических условиях, будет меньше, чем при изотермических.
изменяется значительней. Поэтому давление изменится гораздо больше, чем при изотермическом процессе. При одинаковых начальных условиях P0, V0, T0 и одинаковом расширении газа (от V1 до V2) работа, совершаемая газом в адиабатических условиях, будет меньше, чем при изотермических.
1. Следовательно, все элементарные слагаемые работы и вся сумма окажутся меньше при адиабатическом расширении.
При адиабатическом сжатии затрачивается большая работа, чем при изотермическом. На графике (рис. 2.4) видно, что при сжатии адиабата поднимается, при расширении опускается круче изотермы.

Рис. 2.4. Кривые адиабаты и изотермы
dA=-dE=Cv·dT; A=-Cv·T+c;
A=Cv·(T0-T)=Cv-T0·(l-T/T0). (2.19)
Это выражение говорит о том, что при адиабатическом переходе с одной изотермы на другую всегда совершается одна и та же работа.
2.3. Применение первого начала термодинамики к биологическим процессам. Физические основы терморегуляции организма
Жизнь может поддерживаться только в сравнительно узких интервалах температур: нижний - температура кристаллизации водных растворов, верхний - не выше 60-80 °С, так как при высоких температурах происходит денатурация белков. Имеются в природе отклонения от данных интервалов. Так, известно, что сперматозоиды для искусственного оплодотворения удается сохранить при температуре жидкого азота, а для уничтожения некоторых вирусов содержащие их растворы приходится нагревать до температуры более 100 °С. Однако при очень низких и очень высоких температурах не приходится говорить об активных формах жизни.
Живой организм — открытая термодинамическая система, и поддержание этой системы при постоянной температуре возможно лишь при непрерывном обмене тепловой энергии между организмом и внешней средой, а это возможно при наличии в организме источников тепла. На один из источников "животного тепла" указал французский химик XVIII века А.Л. Лавуазье, который установил, что сущность дыхания заключается в экзотермической (то есть происходящей с выделением энергии) реакции присоединения кислорода воздуха к водороду и углероду, которые находятся в молекулах органических веществ. Поэтому жизнь, по мнению Лавуазье, "замедленное горение". Виды превращения энергии в организме и его органах приведены в таб. 2.1.
Немецкий ученый Ю.Р. Майер в XIX веке обратил внимание, что в жаркую погоду потребление кислорода организмом уменьшается. Цвет венозной крови ярче у людей в тропиках, чем в северных районах. Все это позволило сделать вывод, что выделяющаяся в процессе окисления внутри живого организма энергия частично превращается в тепло, а частично расходуется при совершении организмом механической работы. Таким образом, Майер впервые распространил первое начало термодинамики на живой организм и заложил основы биоэнергетики.
Таблица 2.1
Превращение энергии в живых организмах
| Виды превращаемой энергии | Участки организма, в которых эти превращения происходят |
| Химическая энергия в механическую | Мышечные ткани |
| Химическая энергия в электрическую | Все клетки |
| Химическая энергия в световую | Светящиеся ткани у рыб и насекомых |
| Световая энергия в химическую | Фоторецепторы сетчатки глаза, клетки кожи, бактерии, листья растений (фотосинтез) |
| Механическая энергия акустических волн в электрическую | Внутреннее ухо |
| Все виды энергии в тепловую | Все клетки и ткани |
Поскольку в основе всех жизненных процессов лежит окисление питательных веществ с последующим выделением организмом веществ метаболизма и теплоты, то необходимо сравнивать количество теплоты, которое выделяет организм, с тем которое можно получить при непосредственном окислении продуктов питания. По закону Г.И. Гесса, тепловой эффект химической реакции, развивающийся через ряд последовательных стадий, зависит лишь от разности энергий исходного и конечного состояний химических систем. Закон Гесса широко используют в биологии для определения теплоснабжения (калорийности) продуктов питания. Продукты сжигают в термостате и определяют количество теплоты, которое образуется при окислении продуктов кислородом. Удельная теплота сгорания белков 24,3 мДж/кг, углеводов - 17,6 мДж/кг.
Доказано, что потребление 1 л кислорода или выделение 1 л углекислого газа организмом сопровождается выделением 21,35 кДж теплоты. Таким образом, тепловыделение в организме любого животного легко посчитать, умножив 21,35 кДж на количество потребляемого кислорода или выделенного углекислого газа в литрах. Теплопродукция является важной физиологической характеристикой, которая характеризует интенсивность обмена веществ.
Непрямая калориметрия — это, когда на голову испытуемому надевают герметическую респирационную камеру, позволяющую измерить количество кислорода, которое потребляется за сутки или величину выделяемого углекислого газа за то же время. Более точные значения дает метод прямой калориметрии. Человека или животное помещают в большой калориметр с теплоизолированными стенками, в котором находится источник кислорода для дыхания, и подсчитывают количество поглощаемого кислорода или выделяемого углекислого газа. Сравнивают с теплосодержанием продуктов питания, которое потребляется животным за время эксперимента. Погрешность эксперимента 0,26%. Таким образом, эксперименты подтверждают, что энергетический баланс организма находится в полном соответствии с законом сохранения энергии и что никаких специфических источников "жизненных сил" в организме не существует.
2.3.1. Теплопродукция организма
Живой организм в какой-то степени сходен с тепловой машиной. Он выделяет теплоту в окружающую среду, то есть обладает свойством теплопродукции за счет энергии, полученной от продуктов питания или от фотосинтеза, и, кроме этого, выполняет различные виды работы: механическую, электрическую, химическую, осмотическую. В конечном счете, все виды энергии превращаются в теплоту, которая выводится в окружающую среду и энтропия при этом возрастает.
Химическая энергия - это работа, совершаемая клеткой при синтезе высокомолекулярных веществ (белков, нуклеиновых кислот и др.) из низкомолекулярных (жиры, углеводы), которые поступают в организм извне, при воспроизводстве клеток, а также при других происходящих в организме химических реакциях.
Механическая работа – это работа, выполняемая мышцами при их сокращении и затрачиваемая на перемещение тела в пространстве.
Электрическая работа имеет место в мембранах клеток при генерации биопотенциалов, при проведении возбуждения в нервных клетках.
Работа по оптическому высвечиванию расходуется на люминесценцию, то есть свечение организмов, некоторые из которых могут светиться долго. Многие ткани испускают сверхслабое свечение.
Осмотическая работа совершается при активном транспорте веществ через клеточные мембраны против градиента концентрации.
Аккумулирование энергии в целом организме происходит в сложных биохимических соединениях. Важнейшим из них является АТФ. Разрыв макроэнергетической связи в молекуле АТФ приводит к выделению энергии от 25 до 38 кДж/моль. С точки зрения термодинамики, молекулу АТФ как систему можно считать богатой энергией, а молекулу АДФ - системой с меньшей энергией. Синтез АТФ происходит в мембранах митохондрии и заключается в присоединении к АДФ фосфатной группы при участии фермента за счет энергии окисления органических веществ. Этот процесс носит название окислительного фосфорирования.
В клетках, в зависимости от их типа, находится несколько сотен митохондрий. В растительных клетках синтез АТФ осуществляется под действием энергии света, в результате чего образуется кислород и АТФ. Этот процесс называется фотофосфорированием. Сопряженный с ним процесс синтеза органических веществ называется фотосинтезом. При увеличении теплоотдачи теплокровными животными возрастает теплопродукция, что необходимо для поддержания температуры тела. Выделение теплоты происходит в скелетных мышцах и внутренних органах и зависит от возраста, пола, питания, степени акклиматизации и мышечной нагрузки. Общее количество теплоты, выделяемой человеком за год, примерно равно 4 ГДж.
М. Клейер (1932 г.) показал, что теплопродукция, то есть количество теплоты, выделяемое в единицу времени:
QТ =Q/t, (2.20)
где QT зависит от массы животного и может быть выражено следующей эмпирической формулой:
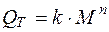 . (2.21)
. (2.21)
По экспериментальным данным М. Клейера, n=0,75.
Прологарифмируем уравнение (3.21):
lgQT=lgk+n·lgM. (2.22)
В логарифмических координатах графиком этой зависимости будет прямая линия, на которую хорошо ложатся точки, полученные экспериментально для разных животных (рис. 2.5).
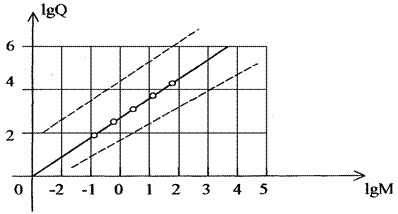
Рис. 2.5. Зависимость теплопродукции от массы животных
В 1967 году А.И. Быховский предположил, что теплопродукция организма может быть выражена как сумма двух членов:
1) QB - теплопродукция, связанная с взаимодействием клеток организма между собой и пропорциональная общей массе организма (М);
2) QС - теплопродукция, которая обусловлена взаимодействием организма с окружающей средой, то есть пропорциональна площади его поверхности: 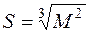 .
.
таким образом,
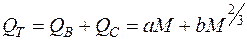 , (2.23)
, (2.23)
где a и b – эмпирические коэффициенты.
Удельной теплопродукцией называется величина, численно равная количеству теплоты, которая выделяется единицей массы животного в единицу времени. g=QT/M, или, после преобразований, 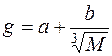 .
.
Опытные данные позволили вычислить значения коэффициентов: a=41,9 кДж/(кг·сутки); b=244 кДж/(кг·сутки).
Таким образом, с увеличением размеров и массы животного увеличивается отношение его поверхности к объему, а чем больше удельная поверхность, тем большее количество теплоты уходит из тела во внешнюю среду. Поэтому для поддержания постоянной температуры теплопродукция должна возрастать. Для компенсации большой потери теплоты мелким животным требуется повышение интенсивности метаболизма и, следовательно, потребление большого количества пищи. Этим объясняется прожорливость грызунов и птиц. Некоторые певчие птицы потребляют за сутки количество пищи, равное их собственной массе, тогда как хищники (лев, тигр) съедают в сутки пищи всего 5-8% от собственной массы.
2.4. Перенос теплоты в живых организмах. Термометрия
Благодаря теплопродукции температура тела у теплокровных животных обладает постоянством и не зависит от внешней среды. Только при длительном охлаждении тела температура его может понижаться.
Живые организмы в ходе эволюции выработали механизмы, которые могут повышать или понижать температуру, увеличивать или повышать теплообмен. Показано, что при охлаждении животного в его клетках увеличивается скорость гидролиза АТФ и в мышцы поступает дополнительная энергия. Возникающее при этом беспорядочное сокращение отдельных групп мышечных волокон мы называем дрожью. При повышении температуры среды в организме возникают процессы, которые приводят в действие термопонижающие центры, в результате чего происходит расширение кровеносных сосудов, увеличивается потоотделение, учащается дыхание. Чувствительностью элементного механизма, ответственного за поддержание постоянной температуры тела, служат два центра в гипоталамусе. Один из них реагирует на повышение температуры, другой - на ее понижение. Перенос тепла осуществляется потоком крови. Тепло оказывает благоприятное влияние на организм:
1) увеличивается поступление кислорода в ткани;
2) происходит увеличение тока лимфы;
3) облегчается поступление крови в ткань;
4) наблюдается ускорение реакции защитных механизмов крови против инфекции;
5) увеличивается локальная стимуляция защитных механизмов ткани.
Точные измерения температур являются неотъемлемой частью научно-исследовательских и технических работ. Диапазон температур очень широкий. Самая низкая температура приближается к абсолютному нулю. Верхний предел не ограничен. Наибольшая температура достигнута в земных условиях при взрыве водородной бомбы и составляет 108 К. Температурный интервал окружающей среды, в которой могут длительно или кратковременно находиться биологические системы, сохраняя способность к функционированию, невелик (приблизительно от 0 до 90°С). Температура не может быть измерена непосредственно. Для ее измерения установили температурную шкалу и выбрали термометрическое вещество. Для этого выбирают две реперные точки, соответствующие температурам фазовых переходов, например: плавления льда, кипения воды и т.д.; участок шкалы между этими точками называется основным интервалом. За начало отсчета принимают одну из реперных точек (например, 0 °С температуру таяния льда). 1 °С составляет 0,01 доля основного интервала. Температурные шкалы различают по термическому свойству или веществу. Независимо от свойств и веществ, температурная шкала построена на основе второго начала термодинамики и названа термодинамической шкалой температур. Единицей термометрической шкалы является Кельвин. 1К=1/273,16»0,01 ºС температуры тройной точки чистой воды. Любая эмпирическая шкала всегда приводится к термометрической. Для измерения температур используют: термометр, термопару, термистор, пирометры.
Термометры — это устройства для измерения температуры. Они состоят из чувствительного элемента, в котором реализуется термометрическое свойство, и измерительного прибора.
Используемый в медицине ртутный термометр указывает максимальную температуру и называется максимальным термометром. Эта особенность обусловлена его устройством — резервуар с ртутью отделен от градуированного капилляра волосяным сухожилием, которое не позволяет ртути при охлаждении термометра возвратиться в резервуар. Существует минимальный термометр, который показывает наименьшую температуру, наблюдаемую за длительный промежуток времени. Для измерения температуры с большой точностью в небольшом интервале значений служит статический термометр. Цена деления такого термометра равна 0,01 °С.
В медицине, с целью местного нагревания или охлаждения, применяют нагретые или охлажденные тела. Для этого выбирают доступные среды, физические свойства которых обусловливаются их назначением:
1) должны иметь большую удельную теплоемкость (вода, грязи) для длительного эффекта;
2) не должны вызывать болезненных ощущений;
3) если удельная теплоемкость низкая, такое вещество нагревают до большой температуры, лишь бы оно не вызывало раздражений (например, парафин нагревают до 70 °С).
Парафин и озокерит получают из отходов парафинированной нефти. Их используют при высокой температуре (до 80 °С) без риска ожога кожи. Это объясняется тем, что непосредственно соприкасающийся с кожей слой парафина быстро остывает (до 45 °С) и, вследствие малой теплопроводности, защищает кожу от соприкосновения с остальными его слоями. Значительное количество тепла выделяется при отвердении парафина, при этом масса парафина сжимается и умеренно сдавливает лежащие под ним ткани, устраняя избыточное расширение кровеносных сосудов. Аналогичным свойством обладает озокерит. Парафино-озокеритолечение широко применяется при лечении радикулитов и других заболеваний.
В качестве охлаждающего средства используют лед. В последнее время в медицине широко используются низкие температуры.
Криогенный метод разрушения ткани при замораживании и размораживании используется для удаления миндалин, бородавок и т.д. Для этого создаются специальные криогенные аппараты и криозонды. В связи с применением низких температур в медицине появились новые направления: криогенная медицина, криотерапия, криохирургия (крио- от греч. «холод» - относящийся к низким температурам).
2.5. Понятие энтропии. Второе начало термодинамики
Существует несколько формулировок второго начала термодинамики. Одной из центральных является следующая: невозможен процесс, единственным результатом которого было бы превращение теплоты в работу, то есть невозможен двигатель второго рода. Вечным двигателем второго рода называется двигатель, который, повторяя произвольное число раз один и тот же процесс, способен превращать в работу все тепло, полученное у какого-нибудь тела или тел, играющих роль источника, то есть не нуждается в телах, служащих для стока теплоты, не превращенной в работу.
Дата добавления: 2020-11-18; просмотров: 389;











