Плотные шаровые упаковки. Кристаллы простейших соединений
Сопротивление кристаллов пластической деформации в значительной степени связано с плотностью расположения атомов в кристаллической решетке и типом связи между атомами. На рисунках, приведенных выше, атомы изображены шарами сравнительно малого радиуса, не соприкасающимися друг с другом. В действительности, из принципа минимума потенциальной энергии следует, что каждый атом стремится взаимодействовать с максимально большим числом других атомов.
Введем понятие координационного числа — числа ближайших соседних атомов, окружающих данный атом. Если коэффициент компактности — отношение объема шаров ко всему объему, включая пустоты между шарами, — будет наибольшим по сравнению с другими возможными упаковками, то такие упаковки носят название плотных.
Так, примером одномерной плотной упаковки может служить линейная периодическая цепочка шаров с периодом, равным 2R (координационное число для такой упаковки, очевидно, равно двум).
Плотная упаковка шаров на плоскости представляет собой двухмерную периодическую структуру с гексагональной симметрией и координационным числом, равным шести. Плоская элементарная ячейка такой структуры — ромб со сторонами длиной 2R, соединяющими центры ближайших атомов. Каждый атом в слое на рис. 1.3 обозначен буквой А.
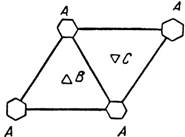
Рис. 1.3. Схема элементарной ячейки в плоской шаровой упаковке
Для получения пространственной структуры необходимо провести наложение атомных слоев. Из рис. 1.3 видно, что между атомами с гексагональной симметрией А в элементарной ячейке (обозначены шестиугольниками) существует два типа пустот В и С, через которые проходят тройные оси симметрии. Каждое из этих семейств осей образует аналогичную плоскую гексагональную сетку.
Второй слой атомов для получения наиболее плотной упаковки, очевидно, необходимо поместить в тригональные лунки В или С. Предположим, ЧТО второй Сдой помещен в положение В. Третий слой может быть помещен в положения А или С. Таким образом, последовательность слоев может быть представлена формулами АВАВАВ... или ABCАВCABC... Первая из рассмотренных схем соответствует гексагональной плотноупакованной структуре, вторая — гранецентрированной
кубической структуре. Существуют плотные упаковки и с большим числом слоев. Общее описание таких упаковок с применением числовых символов предложено Г. С. Ждановым.
Коэффициент компактности структуры q может быть подсчитан из соотношения

где Zj — число атомов типа і в элементарной ячейке, Vi — объем одного атома, Va — объем элементарной ячейки.
Для шаровых упаковок, состоящих из одинаковых шаров, формула (1.1) приобретает вид

Для плотнейших структур координационное число является наибольшим. Для гексагональной плотноупакованной и гранецентрированной кубической структур оно равно 12.
Если подсчитать атомы в элементарной ячейке исходя из модели бесконечного дисконтинуума, то окажется, что в простой кубической структуре, например, приходится 1 атом на ячейку, т. е. каждый из 8 атомов, находящихся в вершинах элементарной ячейки, должен принадлежать одновременно 8 ячейкам. Характеристики компактности для всех рассмотренных выше структур также приведены в табл. 2.
Кристаллы простейших соединений. Многие кристаллы химических соединений, состоящие из разнородных атомов, можно приближенно рассматривать, как идеальные кристаллы.
Рассмотрим структуры некоторых соединений, для которых имеются данные о механизме пластической деформации. Прежде всего, необходимо отметить возможность двойственного подхода к этим структурам. Присутствие чужеродных атомов в решетке искажает силовое
поле, и, следовательно, эти атомы могут рассматриваться, как дефекты в кристалле.
Однако если атомы второго элемента расположены упорядоченно, то трехмерная периодичность решетки сохраняется и меняются только форма и размеры элементарной ячейки. Таким образом, кристаллы химических соединений можно в этом смысле рассматривать как идеальные кристаллы. Большое значение в образовании этих кристаллов имеют различные типы химической связи: ковалентная, металлическая и гетерополярная, в частности, ионная связь. Атомный механизм возникновения различных типов связей подробно рассмотрен в книге Г. С. Жданова.
Структура NaCl. Элементарная ячейка NaCl изображена на рис. 1.4. Шары малого диаметра изображают атомы (ионы) натрия. Если рассматривать положения только атомов натрия, то легко видеть, что они образуют гранецентрированную кубическую решетку. Из рассмотрения двух соседних ячеек следует, что атомы хлора также образуют гранецентрированную кубическую решетку.
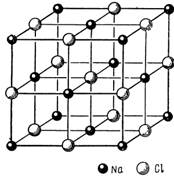
Рис. 1.4. Элементарная ячейка структурного типа хлористого натрия
Таким образом, структура представляет собой две гранецентрированные кубические решетки, вставленные друг в друга. Если не учитывать различий в атомах натрия и хлора, то NaCl имеет простую кубическую структуру. Однако при рассмотрении пластической деформации, например сдвига, такое представление неприемлемо.
Действительно, сдвиг на одно межатомное расстояние в простой кубической решетке не приводит к нарушению правильности расположения атомов, а в решетке NaCl сдвиг на одно межатомное расстояние приводит к тому, что атомная плоскость, состоящая из атомов натрия, в какой-то части совмещается с атомной плоскостью, состоящей из атомов хлора, т. е. нарушается правильность расположения атомов в решетке.
В процессе деформации играет важную роль также и то, что натрий и хлор в решетке NaCl находятся не в виде атомов, а в виде разноименно заряженных ионов. В силу ряда свойств NaCl на этом соединении было получено большое число данных о механизме пластической деформации, применимых не только к ионным кристаллам, но и к металлам. Структуру NaCl имеет также большое количество других соединений, из которых необходимо отметить LiF и MgO, часто используемые при исследованиях механизма пластичности и разрушения твердых тел.
Строго говоря, во всех рассмотренных случаях структура кристаллов не является идеальной по ряду причин. Прежде всего при рассмотрении не учитывались тепловые колебания атомов в твердом теле, которые приводят к тому, что в каждый фиксированный момент времени какое-то число атомов не находится в идеальных положениях равновесия в решетке.
Необходимо отметить, что материалы, являющиеся идеальными кристаллами, в природе не встречаются и искусственное получение кристаллов, близких к идеальным, является очень сложным процессом. Реальные кристаллы всегда содержат примеси чужеродных атомов, а также различные дефекты кристаллической структуры, рассмотренные ниже.
Дата добавления: 2023-03-16; просмотров: 1129;











