Химия соединений. Понятие о химических реакциях
Когда объединяются два или более атома различных элементов, они образуют химическое соединение. Поскольку существует много различных элементов, возможности для создания новых соединений огромны. Тип связи, удерживающей атомы соединения, определяет его физические свойства, например точку плавления и кипения.
Как связаны атомы. Атомы различных элементов связываются друг с другом с образованием соединений. Это происходит путем приобретения, отдачи или совместного владения электронами на их внешних оболочках.
Большинство ионных соединений - твердые вещества
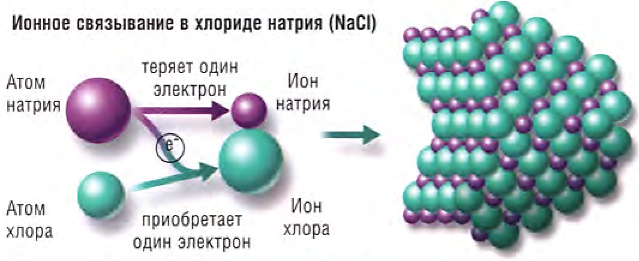
Ионная связь. Примером ионных соединений может служить поваренная соль (NaCI). Каждый атом натрия отдает один электрон внешней оболочки с образованием положительно заряженного иона натрия (Na+); каждый атом хлора приобретает этот электрон, давая отрицательно заряженный ион хлора (СI).
Обладая противоположными зарядами, ионы сильно притягиваются друг к другу. Они организованы в кристаллической решетке (см. ниже), в которой каждый ион окружен максимально возможным количеством противоположных зарядов. Требуется значительная энергия, чтобы нарушить связи между ними.
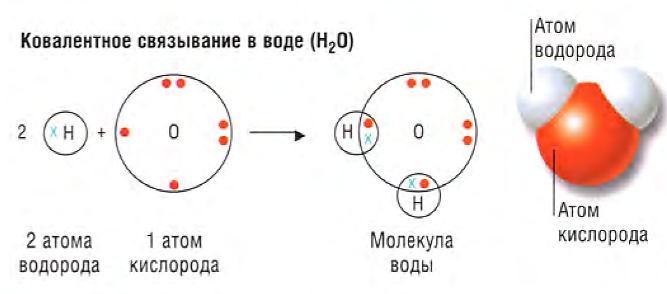
Ковалентная связь. Одинарная ковалентная связь образуется между двумя атомами, когда они совместно владеют парой электронов, причем каждый атом предоставляет один электрон.
Электростатическое притяжение между молекулами слабое. Вследствие этого точки плавления ковалентных соединений обычно ниже, чем ионных, и большинство из них при комнатной температуре - газы или жидкости.
Металлическая связь. В металлах каждый атом имеет сравнительно мало электронов на своей внешней оболочке, поэтому атомы легко теряют эти электроны, превращаясь в положительно заряженные ионы. Образуется мощное притяжение между противоположно заряженными ионами и электронами. Именно поэтому металлы, как правило, прочные вещества и имеют высокую точку плавления.

Понятие о химических реакциях. Химические реакции происходят, когда элементы или соединения претерпевают превращения или взаимодействуют друг с другом с образованием других веществ.
Скорости реакции. Насколько быстро идет реакция или происходит ли она вообще, зависит не только от реактантов, но и от имеющихся условий. Например, нагревание реакционной смеси может ускорить реакцию.
В промышленности часто используют катализаторы для ускорения химических реакций или для их осуществления. Металлы и оксиды металлов, например, могут ускорять реакции между газами, предоставляя поверхность, которая абсорбирует реагирующие молекулы и тем самым сближает их. Катализатор участвует в реакции, но в отличие от реактантов остается неизменным и не расходуется.
Изменения энергии. В любой химической реакции энергия либо выделяется, либо поглощается. При разрушении связи между атомами энергия поглощается, она выделяется, когда связи образуются. Реакция, в которых энергия поглощается, называется эндотермической; когда энергия выделяется, имеет место экзотермическая реакция.
Сжигание топлива - экзотермическая реакция: энергия выделяется. Образование газообразных водорода и кислорода из воды - пример эндотермической реакции: энергия поглощается, чтобы разрушить связи между атомами водорода и кислорода, из которых состоят молекулы воды (Н20).
Химическое уравнение. Химические реакции можно записать в виде уравнений. Например, реакция между натрием и водой записывается следующим образом:
![]()
Однако такое уравнение говорит лишь о том, какие вещества участвуют в реакции. Если ее записать с использованием химических формул, она покажет, что происходит с участвующими атомами и молекулами:
![]()
Но это уравнение не пропорционально, поскольку в правой части больше атомов водорода, чем в левой. Все химические реакции подчиняются простому закону сохранения масс. Он утверждает, что общая масса всех продуктов реакции равна общей массе всех реагентов. Поэтому, чтобы правильно записать уравнение реакции, количество атомов с каждой стороны должно быть одинаковым:
![]()
Теперь понятно, что при реакции натрия с водой два атома натрия соединяются с двумя молекулами воды с образованием двух молекул гидроксида натрия и одной молекулы водорода.
Дата добавления: 2022-12-02; просмотров: 2603;











