Основное уравнение молекулярно-кинетической теории идеального газа
Пусть в сосуде в виде куба со стороной l находится N молекул. Рассмотрим движение одной из молекул. Пусть молекула движется из центра куба в одном из 6 возможных направлений (рис.1) , например параллельно оси Х со скоростью v. Ударяясь о стенку А куба молекула оказывает на него давление (см. рис. 2). Найдем его. Согласно второму закону Ньютона сила давления 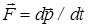 , где
, где 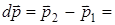
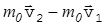 . Предполагая, что происходит абсолютно упругий удар, имеем v1=v2=v. Изменение импульса
. Предполагая, что происходит абсолютно упругий удар, имеем v1=v2=v. Изменение импульса 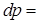
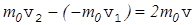 . Молекула
. Молекула
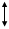   
|
вернется в исходное состояние ( в центр куба) спустя время dt=(0.5l+0.5l)/v=l/v. В итоге получаем выражение для силы давления, оказываемого на стенку сосуда одной молекулой,
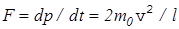 . (10)
. (10)
Если число молекул в сосуде N, то к cтенке А движется
в среднем N/6 молекул и они создают среднюю силу давления на стенку
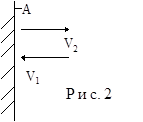
|
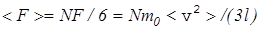 , (11)
, (11)
где <v 2> - cредний квадрат скорости молекул [cм. формулы (17), (18)].
Давление, оказываемое на стенку сосуда, площадь которой S=l2,
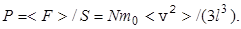 (12)
(12)
Учитывая, что N/l3=N/V=n, т.е. равно концентрации молекул, а также, что
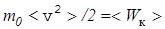 (13)
(13)
-средняя кинетическая энергия поступательного движения молекулы газа, получаем из (12) основное уравнение молекулярно-кинетической теории идеального газа 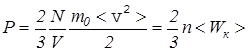 . (14) Такое же давление производят молекулы на другие стенки сосуда, поскольку молекулы газа движутся хаотически и не имеют какого-либо преимущественного направления движения.
. (14) Такое же давление производят молекулы на другие стенки сосуда, поскольку молекулы газа движутся хаотически и не имеют какого-либо преимущественного направления движения.
Итак, согласно (14) давление на стенки сосуда определяется произведением концентрации молекул n на их среднюю кинетическую энергию поступательного движения <Wк>.
1.4. Молекулярно-кинетическое толкование термодинамической температуры Учитывая, что n=N/V=NA(m/M)/V, где V - объем газа, перепишем (14) в виде 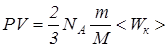 . (15)
. (15)
С другой стороны согласно уравнению Клапейрона-Менделеева РV=(m/M)RT = (m/M)NAkT. Таким образом
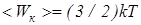 . (16)
. (16)
Итак, термодинамическая температура с точностью до постоянного множителя (3/2)k равна средней кинетической энергии поступательного движения молекулы.
Таково молекулярно-кинетическое толкование термодинамической температуры.
Учитывая, что 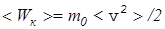 , где
, где
<v2>= 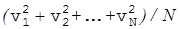 (17)
(17)
средний квадрат скорости молекул газа, из (16) находим среднюю квадратичную скорость <vKB>= 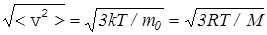 . (18)
. (18)
Например, при t=27° C или T=300 K молекулы кислорода (М=32∙10-3кг/моль) имеют скорость <vKB>=483 м/c.
Дата добавления: 2016-07-27; просмотров: 1533;











