Основные положения молекулярно-кинетической теории
Согласно молекулярно-кинетическим представлениям любое тело состоит из атомов и молекул. Эти частицы находятся в беспорядочном, хаотическом движении, интенсивность которого зависит от температуры тела. Такое движение молекул называют тепловым.
Число атомов и молекул в любом теле огромно. Например, в 1 м3 газа при обычных условиях содержится 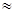 1025 молекул, а в жидких и твердых телах
1025 молекул, а в жидких и твердых телах 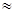 1028 молекул. Если считать, что движение каждого атома или молекулы подчиняется законам классической механики, то практически даже невозможно написать систему дифференциальных уравнений движения такого множества молекул (бумаги на Земле для этого не хватило бы) и решить эту систему. Поэтому поведение отдельной молекулы или атома тела не может быть изучено методами классической механики, тем более, что это поведение (траектория, скорость и другие характеристики движения молекулы) изменяются со временем случайным образом.
1028 молекул. Если считать, что движение каждого атома или молекулы подчиняется законам классической механики, то практически даже невозможно написать систему дифференциальных уравнений движения такого множества молекул (бумаги на Земле для этого не хватило бы) и решить эту систему. Поэтому поведение отдельной молекулы или атома тела не может быть изучено методами классической механики, тем более, что это поведение (траектория, скорость и другие характеристики движения молекулы) изменяются со временем случайным образом.
Физические свойства макроскопических систем, состоящих из большого числа частиц, изучаются двумя взаимно дополняющими методами: статистическим и термодинамическим.
Статистическийметод основан на использовании теории вероятностей и определенных моделей строения изучаемых систем. В совокупном поведении большого числа частиц, координаты и импульсы которых случайны в любой момент времени, проявляются особые статистические закономерности. Например, в газах можно определить средние значения скоростей молекул и их энергий, однозначно связанных с температурой.
Раздел физики, в котором с помощью статистического метода изучаются физические свойства макроскопических систем, называется статистической физикой.
Второй, термодинамический метод исследования поведения большого числа молекул более подробно излагается в 4 и 5 лекциях.
При термодинамическом методе исследования не рассматривается внутреннее строение изучаемых тел, а анализируются условия и количественные соотношения при различных превращениях энергии, происходящих в системе.
Раздел физики, в котором физические свойства макроскопических систем изучаются с помощью термодинамического метода, называется термодинамикой.
Заметим, что статистическая физика и термодинамика при малом числе частиц теряют смысл.
Термодинамика имеет дело с термодинамической системой - совокупностью макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой).
Состояние системы задается термодинамическими параметрами (параметрами состояния). Обычно в качестве параметров состояния выбирают: - объем V, м3; давление Р, Па, (Р=dFn /dS, где dFn - модуль нормальной силы, действующей на малый участок поверхности тела площадью dS, 1 Па=1 Н/м2); термодинамическую температуру Т, К (Т=273.15 +t). Отметим, что термодинамическая температура прежде именовалась абсолютной температурой.
Понятие температуры, строго говоря, имеет смысл только для равновесных состояний.
Под равновесным состоянием понимают состояние системы, у которой все параметры состояния имеют определенные значения, не изменяющиеся с течением времени.
Пример неравновесного состояния - горячее или холодное тело, внесенное в комнату. Спустя какое-то время температура тела установится постоянной и состояние будет равновесным.
Дата добавления: 2016-07-27; просмотров: 1354;











