Уравнение состояния идеального газа
Простейшим объектом, для которого может быть получено уравнение состояния, является идеальный газ.
Идеальным называется газ, молекулы которого имеют пренебрежимо малый собственный объем и не взаимодействуют друг с другом на расстоянии.
Оказывается при нормальных условиях, т.е. давлении Р0=1.013×105Па (что эквивалентно 760 мм ртутного столба или одной физической атмосфере) и температуре Т0=273.15 К (t=0° C) многие газы (Н2, О2, N2, воздух и др.) можно считать с хорошим приближением идеальными. В самом деле, учитывая, что эффективные диаметры d молекул различных газов имеют величины порядка 10-10 м и при нормальных условиях концентрация молекул n=N/V 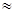 1025 м-3, то среднее расстояние между молекулами <r>
1025 м-3, то среднее расстояние между молекулами <r> 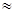
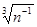 »10-8 м, т.е. столь велики по сравнению с d=10-10 м,что силами притяжения можно пренебречь. Суммарный собственный объем всех N
»10-8 м, т.е. столь велики по сравнению с d=10-10 м,что силами притяжения можно пренебречь. Суммарный собственный объем всех N 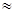 1025 молекул, содержащихся в 1 м3, Npd3/6≈10-5 м3 << 1 м3. Следовательно, собственным объемом молекул газа тоже можно пренебречь.
1025 молекул, содержащихся в 1 м3, Npd3/6≈10-5 м3 << 1 м3. Следовательно, собственным объемом молекул газа тоже можно пренебречь.
Таким образом, многие газы можно считать с хорошим приближением идеальными.
Опытным путем было установлено, что при обычных условиях параметры состояния газов подчиняются уравнению Клапейрона
РV/T=B=const. (1)
Оказалось также, что чем разреженнее газ, тем точнее выполняется это уравнение. Идеальный газ строго подчиняется уравнению (1), которое, следовательно, является уравнением состояния идеального газа.
Согласно закону Авогадро, при нормальных условиях, т.е. при температуре t=0° C (Т0=273.15 К) и давлении одна физическая атмосфера (Р0=1.013×105Па) объем моля любого газа равен V0=22.4 л/моль=22.4×10-3 м3/моль.(Напомним, что единицей количествавещества в СИ является моль. Один моль любого газа содержит одно и то же число молекул NA=6.02×10 23 моль-1, называемое постоянной Авогадро. Массу моля обозначают буквой М). Если m0 - масса одной молекулы, то масса моля или молярная масса
М=m0NA. (2)
Масса моля вещества, выраженного в граммах, численно равна молекулярной массе этого вещества. Например, для кислорода О2 M=32∙10-3 кг/моль, для азота N2 M=28∙10-3 кг/моль. Подставляя эти значения в (1) и обозначая константу В для одного моля буквой R, находим
R= Р0V0/T0=1.013×105×22.4×10-3/273.15=8.31 Дж/моль×К. (3)
Константу R называют универсальной газовой постоянной.
Дата добавления: 2016-07-27; просмотров: 1644;











