Молекулярная адсорбция
Речь идет об адсорбции из растворов неэлектролитов или слабых электролитов. Эти вещества адсорбируются в виде молекул. Особенность такой адсорбции в том, что поверхность адсорбента заполнена молекулами растворителя или адсорбата. Растворенное вещество может адсорбироваться, только вытесняя из поверхностного слоя молекулы растворителя, при этом происходит обменная адсорбция.
(2.4.6.1.1.) Модель идеального двумерного раствора адсорбата и растворителя (этот материал не даю)
Существует ряд моделей адсорбции молекул из разбавленных растворов.
Первая модель предполагает, что адсорбция сводится в образованию монослоя, прилегающего к поверхности адсорбента. Остальные слои — обычный раствор. Этот случай напоминает хемосорбцию газов, но с небольшой теплотой адсорбции и приводит к описанию адсорбции уравнением Ленгмюра
(Г=Г∞ вс /1+ вс) или Фрейндлиха.
Вторая модель рассматривает адсорбцию как полимолекулярный слой, находящийся в монотонно спадающем потенциальном поле твердого адсорбента — уравнение БЭТ.
Модель идеального двумерного раствора адсорбата и растворителя предполагает:
1. поверхность однородна
2. площадь, занимаемая молекулой адсорбата равна площади, занимаемой молекулой растворителя
3. взаимодействие между всеми молекулами одинаковы
4. адсорбция мономолекулярна
Рассмотрим обмен между молекулами как квазихимическую реакцию: 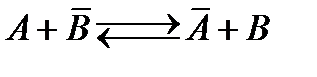 с константой обмена.
с константой обмена.
Константа адсорбционного равновесия этой реакции (константа обмена) равна:
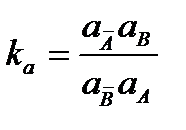 (2.108)
(2.108)
В разбавленных растворах можно считать NA=const
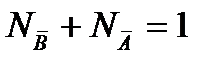
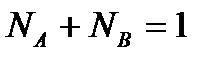 (2.109)
(2.109)
коэффициент активности равен произведению концентрации на коэффициент активности a=Nγ, , поэтому константа kа=k kγ. (k — концентрационная константа). Константу коэффициентов активности в разбавленном растворе можно считать равной единице: kγ=1, тогда:
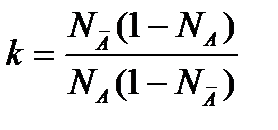 (2.110)
(2.110)
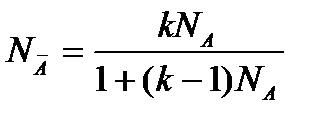 — (2.111)
— (2.111)
общее уравнение изотермы адсорбции из бинарных растворов с константой обмена,
Анализ уравнения показывает, что при NA →0 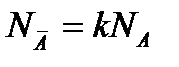 . Рассмотрим графики изотерм адсорбции компонента:
. Рассмотрим графики изотерм адсорбции компонента:
`````1
1 NA
Рис. 2.35. Изотермы адсорбции растворенного компонента в растворе
Кривая 1 отвечает условию k >> 1 и полученное уравнение приобретает вид уравнения (при малых концентрациях растворенного компонента):
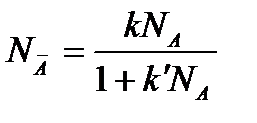
т.е. рассмотренная модель приводит к уравнению вида уравнения Ленгмюра: 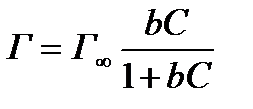
При k<<1 (кривая 2) получаем уравнение вида 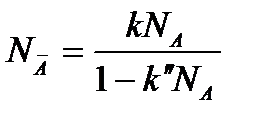
Если k≈1, т.е. величины сродства компонентов к адсорбенту близки, то на форму изотермы влияет коэффициент kγ.
Если поверхностный слой не идеален, то надо учитывать kγ адсорбата и растворителя. Если поверхность неоднородна, используют уравнения Темкина и Фрейндлиха.
Дата добавления: 2016-07-27; просмотров: 2801;











