Адсорбция на границе твердое тело-газ
Характерной особенностью твердых поверхностей является их пористость. Природа поверхности адсорбента, размеры и форма его пор влияют на адсорбцию, изменяют ее количественные и качественные характеристики, т.е. механизм адсорбции.
Твердые поверхности в качестве адсорбентов используются для адсорбции газов или жидкостей, а адсорбционные процессы при этом протекают на границе раздела твердое тело – газ (Т-Г) т твердое тело – жидкость (Т-Ж).
В отличие от поверхности жидкости поверхность твердых тел геометрически и энергетически неоднородна – твердые адсорбенты могут иметь поры. Одной из основных характеристик подобных адсорбентов является пористость П, она равна отношению суммарного объема пор Vп к общему объему адсорбента Vоб, т.е. 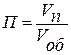 . В зависимости от пористости твердые адсорбенты делятся на две группы: непористые и пористые.
. В зависимости от пористости твердые адсорбенты делятся на две группы: непористые и пористые.
Поверхность раздела фаз у непористых адсорбентов соответствует контуру твердого тела. У пористого адсорбента эта поверхность значительно больше за счет наличия пор. Часто пористые адсорбенты применяют в виде порошков.
Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями могут протекать по разным механизмам и носят общее название сорбции.
Различают четыре основных сорбционных процесса: абсорбцию, адсорбцию, капиллярную конденсацию, хемосорбцию.
Абсорбцией называют поглощение газа или пара всем объемом твердого вещества или жидкости.
Этот процесс состоит в проникновении молекул газа в массу сорбента и заканчивается образованием твердого или жидкого раствора. Распространение молекул газа в твердой или жидкой фазе происходит главным образом путем диффузии. Так как в твердых веществах скорость диффузии очень мала, то абсорбция в них протекает очень медленно и для установления равновесия требуется значительное время.
Адсорбцией называют самопроизвольное концентрирование на твердой или жидкой поверхности раздела фаз вещества с меньшим поверхностным натяжением.
Адсорбция является чисто поверхностным процессом, который заключается во взаимодействии молекул или ионов адсорбата (газа или растворенного вещества) с поверхностью адсорбента за счет сил Ван-дер-Ваальса, водородных связей, электростатических сил. Скорость такого процесса велика, и адсорбция протекает мгновенно.
Капиллярная конденсация представляет собой процесс сжижения пара в порах твердого сорбента. Пар может конденсироваться лишь при температуре ниже критической. Если образующаяся жидкость хорошо смачивает стенки капилляров, т.е. поверхность сорбента, то в капиллярах образуются вогнутые мениски в результате слияния жидких адсорбционных слоев, возникающих на стенках капилляров. Капиллярная конденсация происходит под действием не адсорбционных сил, а сил притяжения молекул пара к поверхности вогнутого мениска жидкости в порах. Протекает она достаточно быстро и заканчивается в течение нескольких минут.
Хемосорбция – это процесс адсорбции, который протекает под действием сил основных валентностей, поэтому ее относят к химической адсорбции.
Вопрос 2. Физическая и химическая адсорбция и их особенности
Адсорбция на твердых поверхностях может быть объяснена наличием силовых полей притяжения, возникающих за счет неуравновешенных связей в кристаллической решетке.
Адсорбционные силы слагаются из валентных сил взаимодействия (химических) и более слабых Ван-дер-ваальсовых (физических). Роль тех и других при различных случаях адсорбции различна. Так, в самом начале адсорбции большинства газов, когда их давление мало, наблюдается химическая адсорбция; с увеличением давления она уступает место физической, которая в основном определяет адсорбцию газов. На адсорбцию влияет не только природа адсорбента, но и адсорбтива. На твердых адсорбентах сильнее адсорбируются те газы, которые легче сжижаются, т.е. критическая температура которых выше.
Физическая адсорбция является обратимым экзотермическим процессом; при повышении температуры адсорбция уменьшается, а десорбция усиливается. Теплоты физической адсорбции невелики и обычно составляют 8-20 кДж/моль. Физическая адсорбция не носит специфического избирательного характера. Хемосорбция, напротив, специфична. Она зависит как от природы адсорбента, так и от природы адсорбата. Энергия связи адсорбент – адсорбат достаточно велика и примерно равна теплоте образования химических соединений (80-800 кДж/моль). С повышением температуры хемосорбция возрастает, подчиняясь законам химической кинетики и равновесия гетерогенных реакций. Хемосорбция часто необратима и приводит к образованию прочных поверхностных соединений между адсорбентом и адсорбатом.
Следует отметить, что явления физической и химической адсорбции четко различаются только в крайних случаях. Обычно осуществляются промежуточные варианты, когда основная масса адсорбированного вещества связывается сравнительно слабо (физическая адсорбция) и лишь небольшая часть связана прочно и может быть удалена длительным прогреванием и вакуумированием (химическая адсорбция). Например, кислород на металлах или водород на никеле адсорбируются при низких температурах по законам физической адсорбции, но при повышении температуры начинает протекать адсорбция с заметной энергией активации. В определенном интервале повышения температур прирост химической адсорбции перекрывает падение физической адсорбции.
Вопрос 3. Основные положения теории адсорбции
Существуют теории : мономолекулярной адсорбции (Теория мономолекулярной адсорбции Ленгмюра), теория полимолекулярной адсорбции (Теория полимолекулярной адсорбции Поляни) и Обобщенная теория Брунауэра, Эммета и Теллера (БЭТ).
Вопрос 4. Понятие о молекулярной и полимолекулярной адсорбции. Уравнение изотермы адсорбции Ленгмюра и его физический смысл.
В 1915г. И.Ленгмюр предложил теорию мономолекулярной адсорбции. Уравнение изотермы адсорбции Ленгмюра справедливо для широкого интервала концентраций и для границ раздела, как подвижных (ж-г, ж-ж), так и твердых (т-г, т-ж).
Вывод уравнения изотермы Ленгмюра для твердых адсорбентов базируется на ряде исходных предпосылок:
1) адсорбционные силы подобны силам основных валентностей и действуют на малых расстояниях;
2) адсорбционной активностью обладает не вся поверхность, а лишь определенные активные центры, расположенные преимущественно на выпуклых участках поверхности: выступах, ребрах, углах;
3) молекулы адсорбированного газа фиксируются на адсорбционных центрах, не перемещаются по поверхности адсорбента и не взаимодействуют друг с другом.
4) Каждый активный центр обладает малым радиусом действия и способен насыщаться. Поэтому активный центр может провзаимодействовать лишь с одной молекулой адсорбата. В результате этого на поверхности адсорбента может образоваться только один (мономолекулярный) слой адсорбата (мономолекулярная адсорбция).
5) Адсорбированные молекулы удерживаются данным активным центром только в течение определенного промежутка времени. Через некоторое время молекулы отрываются от активного центра и переходят в газовую фазу.
Уравнение изотермы адсорбции Ленгмюра для адсорбции из растворов уравнение имеет вид:
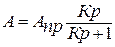 (1)
(1)
для адсорбции газов:
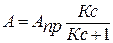 (2)
(2)
где К – константа равновесия адсорбции. Она тем больше, чем сильнее выражено сродство данного адсорбируемого вещества к данному адсорбенту. Помимо природы адсорбента и адсорбата на величину К влияет температура. С повышением температуры усиливается процесс десорбции, так как возрастает кинетическая энергия молекул адсорбата и константа К уменьшается.
АПР - предельная адсорбция. Величина АПР зависит от числа адсорбционных центров на единице поверхности или массы адсорбента и размеров молекул адсорбата. Чем крупнее молекулы адсорбата, тем больше площадь, приходящаяся на молекулу в адсорбционном слое, и тем меньше величина АПР.
|
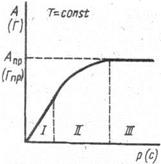
Графическое изображение изотермы адсорбции Ленгмюра приведено на рис. 1. Для кривой характерно наличие трех участков: начального линейного, среднего в виде отрезка параболы и конечного линейного, идущего параллельно оси абсцисс.
Рис 1 Изотерма адсорбции Ленгмюра
Анализ уравнения Ленгмюра показывает, что в зависимости от концентрации адсорбата оно может принимать различные формы.
При малых концентрациях, когда К<<1, этой величиной в знаменателе можно пренебречь и уравнение принимает вид:
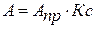 (3)
(3)
Согласно этому выражению, адсорбция растет линейно с увеличением концентрации. На графике изотермы адсорбции этому условию соответствует начальный участок кривой (I).
В области больших концентраций К>>1 и в знаменателе уравнения (2) можно пренебречь единицей, тогда
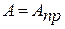 (4)
(4)
Полученное равенство указывает на насыщение поверхности адсорбатом. На графике изотермы адсорбции этому условию соответствует горизонтальный линейный участок III, на котором величина адсорбции уже не зависит от концентрации. Для описания среднего участка кривой используют уравнение Фрейндлиха.
Определения величин К и АПР в уравнении Ленгмюра проводят графическим способом. Для этого берут линейную форму уравнения. Для этого делят единицу на обе части уравнения ( ) . Получают уравнение типа y=a+bx:
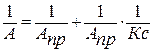 (5)
(5)
График представляет собой прямую (рис.2):
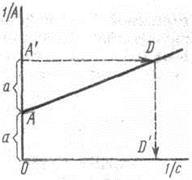
|
Рис 2 Графическое определение констант уравнения адсорбции Ленгмюра: ОА=α=1/Апр; ОD'=1/С1/2=К
Отрезок оси ординат ОА=а, отсекаемый при экстраполяции прямой, равен величине обратной АПР.
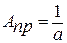 (6)
(6)
Дата добавления: 2016-11-04; просмотров: 9807;











